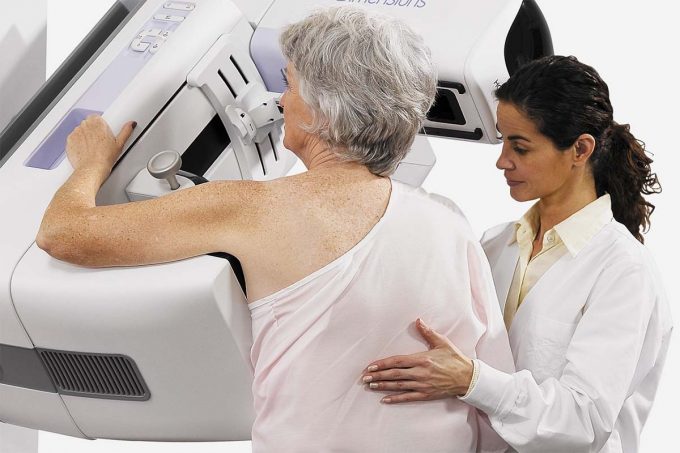
Gilead ha anunciado que la Comisión Europea ha concedido la autorización de comercialización a sacituzumab govitecán (comercializado como Trodelvy), un nuevo fármaco indicado en pacientes adultas con cáncer de mama triple negativo.
Trodelvy es un conjugado anticuerpo-fármaco dirigido a Trop-2 y primero de su clase, que puede ser utilizado como monoterapia para el tratamiento de pacientes adultos con cáncer de mama triple negativo (CMTN) irresecable o metastásico que hayan recibido dos o más tratamientos sistémicos previos, al menos uno de ellos para la enfermedad avanzada.
El CMTN es el tipo de cáncer de mama más agresivo y representa aproximadamente el 15% de todos los cánceres de mama. Se diagnostica con mayor frecuencia en mujeres jóvenes y premenopáusicas y es más frecuente en mujeres de raza negra e hispanas. La tasa de supervivencia a cinco años de este subtipo de cáncer de mama es del 12%, en comparación con el 28% de otros tipos de cáncer de mama, y estos malos resultados suelen ir acompañados de una importante disminución de la calidad de vida, especialmente en la enfermedad recidivante/refractaria.
“El estadio metastásico del CMTN es especialmente difícil de tratar y necesitábamos urgentemente nuevas opciones de tratamiento para las personas que padecen esta enfermedad en Europa”, ha declarado Véronique Diéras, oncóloga médica Principal del Grupo de Cáncer de Mama del Departamento de Oncología Médica del Centro Eugène Marquis de Rennes (Francia). Según ella, la aprobación realizada “que incluye el CMTN metastásico de segunda línea, es significativa para toda la comunidad médica ya que es un importante paso para ayudar a las mujeres con esta enfermedad a vivir más tiempo”, concluye.
“En Gilead, intentamos superar nuestros límites para ofrecer ciencia transformadora y opciones de tratamiento novedosas que aborden necesidades médicas urgentes”, ha destacado Merdad Parsey, el director Médico de Gilead. “Entendemos lo difícil que es tratar el CMTN metastásico y estamos orgullosos de que Trodelvy pueda ofrecer ahora una opción de tratamiento de segunda línea con el potencial de alargar la vida de las personas que viven con esta agresiva enfermedad”, ha indicado.
La decisión de la Comisión Europea está respaldada por los resultados del estudio de fase 3 ASCENT, donde se demuestra que la molécula redujo el riesgo de muerte en un 49% y mejoró la mediana de la supervivencia global a 11,8 meses frente a 6,9 meses con la quimioterapia elegida por el médico (HR: 0.51; 95% CI: 0.41-0.62; p<0.0001). Estos datos también mostraron una reducción estadísticamente significativa y clínicamente significativa del 57% en el riesgo de muerte o empeoramiento de la enfermedad y una mejora de la mediana de la supervivencia libre de progresión (SLP) hasta los 4,8 meses desde los 1,7 meses observados con la quimioterapia elegida por el médico únicamente entre todos los pacientes aleatorizados, que incluían a aquellos con y sin metástasis cerebrales (HR: 0.43; 95% CI: 0.35-0.54; p<0.0001). Las reacciones adversas de grado 3 o superior más frecuentes fueron neutropenia (49,5%), leucopenia (12,0%), diarrea (10,7%), anemia (10,1%), neutropenia febril (6,6%), fatiga (5,2%), hipofosfatemia (5. 2%), náuseas (4,1%) y vómitos (3,0%).
La comercialización de este medicamento también supone un hito para Gilead que entra de forma definitiva en el área oncológica de tumores sólidos, tras el lanzamiento previo de sendos CAR-T.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: