Las redes sociales, especialmente en los ámbitos y grupos en los que se mueven los farmacéuticos han vivido unas horas de estupor y asombro a cuenta de la aparición de unas fotografías de unos envases de Montelukast UR 10 mg, fabricado por Aristo Pharma, en los que parecía que se hubiera manipulado la fecha de caducidad tanto del envase exterior como del acondicionamiento primario, con el objetivo de extender su validez más allá de lo que la Agencia Española de Medicamentos hubiera avalado.
La polémica se ha visto incrementada por un elemento adicional que ha hecho crecer aún más la indignación de los farmacéuticos: el Montelukast UR es el que la Junta de Andalucía ha seleccionado en el ámbito de las subastas de medicamentos, por lo que las dudas acerca de la calidad han surgido rápidamente.
Esta situación ha crecido exponencialmente y ha necesitado incluso de la actuación de la Consejería de Salud andaluza para, vía twitter, explicar que había solicitado a Aristo la certificación que le autorizaba al reetiquetado de dichos medicamentos. Posteriormente, la propia Consejería ha hecho públicos los documentos que avalan que el medicamento cuenta con la autorización preceptiva de la Aemps para la actualización de la fecha de caducidad de los envases de Montelukast UR 10 mg.
Comunicación de @aristopharmaib sobre la autorización de @sanidadgob @AEMPSGOB para la ampliación del período de caducidad de montelukast pic.twitter.com/wfpZJzBEsJ
— Consejería de Salud (@saludand) 7 de noviembre de 2017
Según se detalla en la documentación hecha pública por la Consejería de Salud, con fecha 1 de marzo la Aemps concedió a Aristo Pharma los permisos necesarios para ampliar la caducidad en base a una modificación tipo I-B. La autorización amplía el periodo de vigencia desde los 30 a los 60 meses.
Además, Aristo ha hecho pública, con fecha 7 de noviembre, una comunicación en la que informa de que "el reetiquetado se ha sido realizado por fabricantes que cumplen con las Normas de Correcta Fabricación", también concedidas por la Aemps. No obstante, en algunos ámbitos se han expresado dudas acerca de que se hayan utilizado los medios adecuados de forma que impidieran acceder a los datos anteriores, algo que es posible tal y como demuestran las fotografías publicadas.
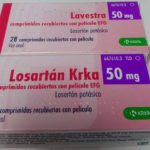
Esta no es la primera polémica que envuelve a la información del envase en medicamentos de las subastas. Hace unos meses en el diazepam Bluefish, se incluyó en el cartonaje símbolos que obligaban a la exigencia de visado de inspección para su dispensación que, como en el resto de medicamentos con este principio activo, no es preceptivo. Igualmente KRKA modificó el envase de su losartan y eliminó las siglas de Tratamiento de Larga Duración (TLD).















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: