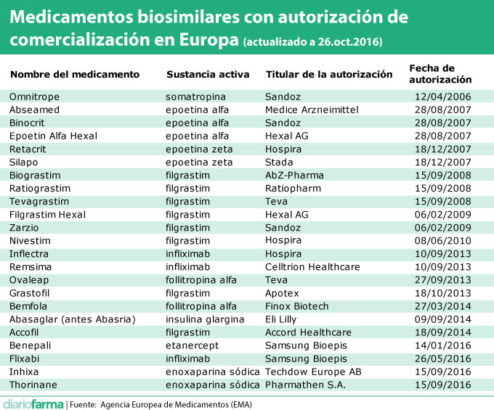
La Comisión Europea ha autorizado la comercialización de dos nuevos biosimilares. En este caso se trata de Inhixa y Thorinane, biosimilares de enoxaparina sódica, que es comercializado por Sanofi como Clexane.
Estos dos nuevos biosimilares, que deberán iniciar ahora los trámites nacionales para poder ser comercializados, han logrado exactamente las mismas indicaciones que había obtenido Clexane, es decir, prevención del tromboembolismo venoso, especialmente en pacientes que vayan a someterse a una intervención quirúrgica; enfermedades asociadas a la formación de coágulos de sangre como la trombosis venosa profunda; angina de pecho inestable; ciertos tipos de infarto de miocardio; o la prevención de la formación de coágulos en circulación extracorpórea en hemodiálisis.
Con esta autorización, dos nuevos laboratorios se suman a los pocos que han logrado desarrollar con éxito un biosimilar. Techdow Europe, filial de un labotatorio chino y Pharmathen, griego, se suman a otros doce laboratorios (o grupos de ellos) que comercializan algún biosimilar en Europa.
La autorización se ha realizado para cinco presentaciones de diferentes dosificaciones. En concreto para 2.000 UI; 4.000 UI; 6.000 UI; 8.000 UI y 10.000 UI en formatos de 2 y 10 jeringas precargadas.
Hasta el momento, la Agencia Europea de Medicamentos (EMA) ha autorizado hasta el momento 23 medicamentos biosimilares de nueve sustancias activas diferentes en los diez años que han transcurrido desde la aprobación del primero de ellos.




















 :
:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.:  Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):
Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):  Javier Padilla, secretario de Estado de Sanidad:
Javier Padilla, secretario de Estado de Sanidad: