Artículo de opinión de Ana Mozetic, Senior Director y responsable; Laura Sánchez-Calero Huidobro, Senior Manager; Iván Bouza Leirós, Senior Consultant y Elena Aldareguia Olano, Consultant de la división de LS de Madrid, Simon-Kucher & Partners

En los últimos 3 años, y pese a la pandemia originada por el SARS-CoV-2, la Comisión Interministerial de Precios de los Medicamentos (CIPM), se ha reunido en hasta 28 ocasiones.
En estas reuniones, la CIPM establece los acuerdos referentes a la financiación de los medicamentos que se incluirán en la Cartera Común de Servicios del Sistema Nacional de Salud, que, en caso de ser aceptados por el laboratorio, son ratificados por la Dirección General de Cartera Común de Servicios del Sistema Nacional de Salud y Farmacia y se hacen efectivos.
Dichos acuerdos pueden agruparse en dos bloques - acuerdos de precio y financiación (aceptación) y acuerdos denegatorios – dividiéndose a su vez cada bloque en: acuerdos referentes a nuevos medicamentos1, nuevas indicaciones2, alteraciones en la oferta3 o alegaciones4.
Las notas informativas publicadas tras cada reunión de la CIPM reflejan las razones que han motivado cada acuerdo, y son una fuente relevante para resolver algunas cuestiones, como: ¿cuántos acuerdos positivos de financiación se han dado en este contexto de crisis e incertidumbre sanitaria? ¿qué ocurre con los medicamentos que han recibido un primer acuerdo denegatorio de financiación? ¿qué condiciones de financiación acompañan a los medicamentos que han obtenido un acuerdo positivo? ¿qué tendencias se observan en cuánto a medidas de control del gasto?, o ¿qué tipo de acuerdos especiales de financiación son los más frecuentes?
Para contestar con la mayor precisión posible a estas preguntas, desde Simon-Kucher & Partners hemos estudiado en profundidad los acuerdos de financiación reflejados en las notas informativas de las reuniones de la CIPM que tuvieron lugar entre enero de 2019 (Acuerdos CIPM 188) y diciembre de 2021 (Acuerdos CIPM 219). Se han analizado 376 acuerdos de financiación sobre medicamentos agrupados en las categorías de: nuevos medicamentos1, nuevas indicaciones2 o alegaciones4. Se han excluido los acuerdos referentes a las alteraciones en la oferta, es decir, a la modificación de las condiciones de financiación y precio de medicamentos ya incluidos en la prestación farmacéutica del Sistema Nacional de Salud (SNS). Las vacunas, los medicamentos genéricos y biosimilares y los dispositivos médicos tampoco han sido objeto de estudio.
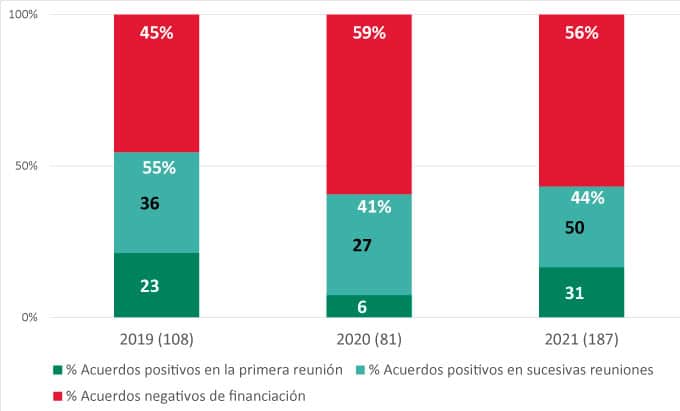
En primer lugar, se observa que, durante este periodo, de los 376 acuerdos de financiación establecidos, un 46% (174) han sido positivos frente a un 54% (202) de acuerdos negativos.
Además, cabe destacar que de aquellos acuerdos que conllevaron la inclusión de algún medicamento en la prestación farmacéutica del SNS, un 64% (111) lo hicieron tras la primera reunión de la comisión en la que se evaluó su oferta, mientras que un 36% (63) lo hicieron en reuniones sucesivas.
Para aquellos acuerdos en los que se produjo una primera denegación, el tiempo medio desde el primer acuerdo denegatorio hasta la aprobación fue de 180 días, siendo el periodo más corto de 43 y el más largo de 777 días.
Gráfica 1: Acuerdos de financiación (2019-2021)
En segundo lugar, y poniendo ahora el foco en los acuerdos positivos establecidos a lo largo de este periodo, se ha buscado entender qué tendencias se observan en términos de condiciones asociadas a la financiación. Para ello, éstas se han agrupado en: 1) condiciones relacionadas con medidas de control del gasto, 2) condiciones que implican una restricción en indicación o acceso al tratamiento y 3) acuerdos especiales de financiación.
- Condiciones relacionadas con medidas de control del gasto
En cuanto al primer grupo, se ha observado que, durante el periodo analizado (2019-2021), un 76% (133) de los acuerdos favorables incluyen algún tipo de medida de control del gasto, entendiendo como tal: seguimiento mensual a través de la plataforma SEGUIMED, establecimiento de reservas singulares para el medicamento5, revisión anual de ventas o revisión anual del precio fijado6.
Gráfica 2: Condiciones relacionadas con medidas de control del gasto (2019-2021) *
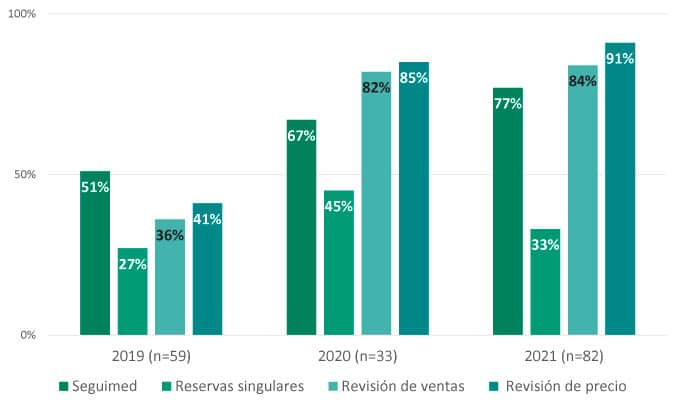
(*) El porcentaje de medidas de control del gasto se ha calculado de forma individual para cada una de las medidas, siendo común que los acuerdos de precio y financiación conlleven más de una medida de control del gasto. Es por esto, que la suma de los porcentajes no equivale a 100% dentro de cada año.
- Condiciones que implican una restricción en indicación o acceso al tratamiento
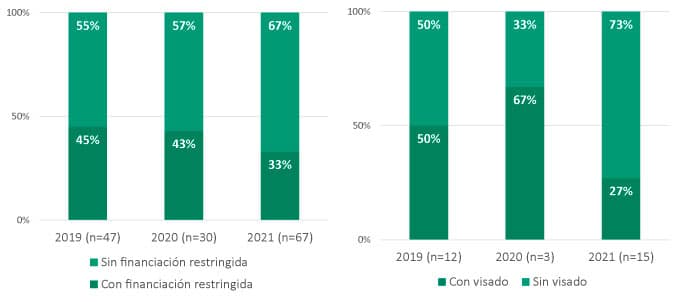
En cuanto a los acuerdos que incluyen algún tipo de medida para restringir la financiación de medicamentos más allá de la indicación aprobada por la Agencia Europea del Medicamento (EMA), conviene diferenciar entre aquellos productos de ámbito hospitalario (144) y aquellos que se dispensan en farmacia comunitaria (30). De los acuerdos relacionados con fármacos dispensados en farmacia de hospital, un 39% (56) de los casos presenta una restricción de financiación frente a la población diana de la indicación. Por otro lado, de aquellos acuerdos de inclusión de medicamentos dispensados en farmacia comunitaria, en un 40% (12) se establece un visado de inspección que implica alguna restricción en la financiación del fármaco.
Gráficas 3 y 4: Condiciones que implican alguna restricción en la financiación (2019-2021) – Medicamentos dispensados en farmacia de hospital vs. medicamentos dispensados en farmacia comunitaria
- Acuerdos especiales de financiación
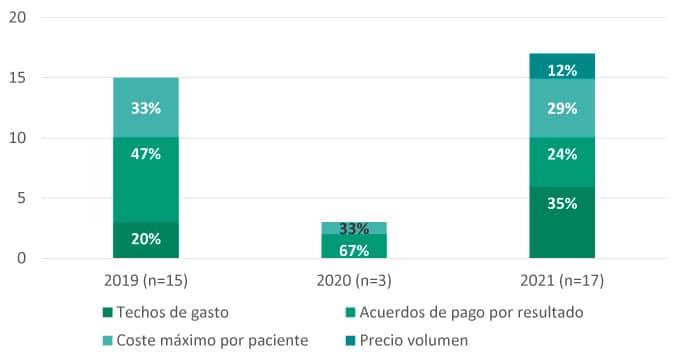
Por último, en lo que refiere a tendencias en acuerdos especiales de financiación, los siguientes tipos de acuerdos son los establecidos para alguno de los medicamentos financiados en el periodo de tiempo evaluado: techo máximo de gasto, acuerdo de pago por resultados, coste máximo por paciente y acuerdo de precio-volumen.
Entre los acuerdos analizados, se observan 14 (8%) modelos de pago por resultados, 11 (6%) de coste máximo por paciente7, 9 (5%) techos máximos de gasto y 2 (1%) modelos de precio-volumen. Asimismo, el 4% (6) de los acuerdos, incluían más de uno de los modelos previamente citados.
Cabe mencionar que, además, 14 nuevos medicamentos (8%) y 3 nuevas indicaciones (2%) fueron incluidas en Valtermed.
Gráfica 5: Acuerdos especiales de financiación (2019-2021)
Entonces, ¿hacia dónde evoluciona la financiación de medicamentos en España?
- Se observa que los acuerdos denegatorios de precio y financiación (al menos tras una primera reunión) son cada vez más frecuentes, por lo que los laboratorios han de recurrir cada vez más al proceso de alegaciones para rediscutir las condiciones de precio y acceso de sus productos.
- Puede concluirse además que la adopción de medidas de control del gasto asociadas a los acuerdos de precio y financiación es hoy muy común. En concreto, la inclusión de fármacos financiados en la plataforma SEGUIMED ha adquirido especial relevancia en los últimos años. Este esfuerzo para controlar el gasto farmacéutico confirma la preocupación por parte de la administración por el creciente impacto presupuestario en farmacia y la sostenibilidad del sistema sanitario español.
- Las restricciones de financiación aplicadas a productos hospitalarios siguen siendo una herramienta comúnmente utilizada por el Ministerio y un recurso para contener el gasto y asegurar el uso del producto donde hay mayor necesidad o mejores resultados clínicos. Si comparamos los tres años analizados, se observa una ligera tendencia decreciente en cuanto al número de acuerdos con restricciones de indicación asociadas, que podría deberse a que el foco de estos acuerdos ha estado más en el precio unitario del producto. Sin embargo, el visado en productos de farmacia comunitaria parece ser una herramienta puesta en marcha de forma muy puntual.
- El desarrollo de acuerdos especiales de financiación parece una práctica muy ligada a la aprobación de medicamentos de alto coste e impacto presupuestario. El entusiasmo observado en 2019 por los acuerdos de pago por resultados, ligado a la puesta en marcha de Valtermed, se ha visto contenido debido a las dificultades asociadas, tanto para clínicos como para la administración, y a la falta de recursos disponibles. Esto explicaría el mayor empleo de modelos financieros, como techos máximos de gasto sobre las ventas totales, coste máximo por paciente (sobre todo para tratamientos cíclicos o de dosis dependiente de peso) o modelos de precio volumen. Así, y pese a que el Ministerio sigue apostando por pagar en base a resultados en salud, los acuerdos basados en resultados se limitan a casos muy especiales y donde el Ministerio de Sanidad percibe una gran incertidumbre clínica, siendo la mayoría de los casos acuerdos mixtos (p.ej., techo máximo de gasto junto con un pago por resultados).
- En definitiva, el gran incremento del impacto presupuestario derivado del gasto farmacéutico es hoy una de las principales preocupaciones del Ministerio de Sanidad, y ha motivado el desarrollo de numerosas medidas para su control.
- Tras el análisis en detalle de las tendencias anteriormente expuestas, desde Simon-Kucher & Partners, consideramos que existen varios factores a tener en cuenta durante la preparación de una negociación de financiación de un medicamento. Entre ellos, recomendamos que:
- Los laboratorios comercializadores reconozcan las incertidumbres clave en torno al producto, así como las principales inquietudes que podría despertar en el Ministerio (ya sean clínicas y/o económicas) e ideen una estrategia para mitigar ambas.
- Además, debe definirse una ruta de negociación clara con pasos y concesiones evaluados en profundidad que ofrezca soluciones asumibles por el sistema y alineadas con el beneficio clínico ofrecido por el fármaco.
- Incluso, para casos de alto coste o de impacto presupuestario considerable, sería recomendable que el laboratorio prepare de antemano diferentes escenarios de impacto presupuestario y proponga algún tipo de acuerdo especial de financiación que permita al Ministerio de Sanidad reducir la incertidumbre presupuestaria del fármaco y pagar únicamente por el valor clínico que este ofrezca.
Consideraciones para el análisis
(1) Acuerdos relativos a la inclusión o no inclusión en la prestación farmacéutica del Sistema Nacional de Salud (SNS) de medicamentos con nuevos principios activos o combinaciones (A.1) y de otros medicamentos (A.2). En lo referente al subapartado A.2; para este análisis sólo se han tenido en cuenta aquellos medicamentos que cambien sus condiciones de comercialización (por ejemplo, por pasar de estar no financiado a entrar en prestación o aquellas nuevas presentaciones que estén ligadas a una extensión de indicación). No se han contemplado primeros genéricos o biosimilares, se ha asumido que reciben las mismas condiciones de financiación que el medicamento original.
(2) Acuerdos relativos a la inclusión o no inclusión en la prestación farmacéutica del SNS de nuevas indicaciones de medicamentos que ya están incluidos en la prestación farmacéutica del SNS.
(3) No se han estudiado las condiciones de financiación de aquellos medicamentos incluidos en el grupo "Alteraciones de la oferta": Acuerdos relativos a las alteraciones en la oferta, es decir, a la modificación de las condiciones de financiación y precio (precio al alza o la baja, condiciones de la prescripción y dispensación, exclusión de la prestación) de medicamentos incluidos en la prestación farmacéutica del SNS. Las vacunas y dispositivos médicos tampoco han sido objeto de estudio.
(4) Acuerdos relativos a los expedientes (pueden ser nuevos medicamentos o nuevas indicaciones) que han obtenido un acuerdo de aceptación o de no aceptación de las alegaciones presentadas por el laboratorio titular del medicamento objeto de expediente.
(5) Establecimiento de reservas singulares en el ámbito del Sistema Nacional de Salud, consistente en limitar su dispensación, sin necesidad de visado, a los pacientes no hospitalizados en los Servicios de Farmacia de los Hospitales.
(6) La revisión anual de los precios ahora fijados se realiza para asegurar que se encuentran en los parámetros establecidos legalmente, y en caso contrario, proceder a su adecuación mediante la rebaja correspondiente.
(7) Negociación de un gasto máximo por paciente, por encima del cual el fabricante paga el 100% del coste excedente (por ejemplo, para mitigar la incertidumbre sobre las dosis basadas en el peso o sobre la duración del tratamiento).
Bibliografía: EMA, BIFIMED, BotPlus, CIPM.
Ana Mozetic, Senior Director y responsable; Laura Sánchez-Calero Huidobro, Senior Manager; Iván Bouza Leirós, Senior Consultant y Elena Aldareguia Olano: Consultant de la división de LS de Madrid, Simon-Kucher & Partners
 Artículo de opinión del equipo de la división de LS de Madrid, Simon-Kucher & Partners sobre los resultados de las negociaciones de precios de los medicamentos en España.
Artículo de opinión del equipo de la división de LS de Madrid, Simon-Kucher & Partners sobre los resultados de las negociaciones de precios de los medicamentos en España.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: