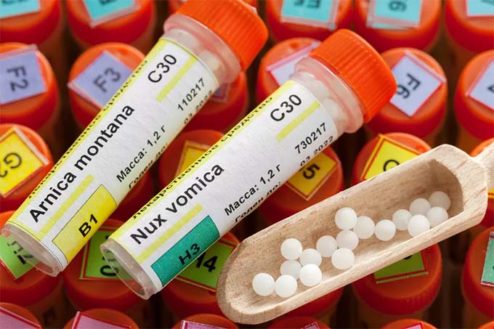
El Boletín Oficial del Estado (BOE) de 28 de abril de 2018 ha publicado la Orden SSI/425/2018, de 27 de abril, por la que se regula la comunicación que deben realizar los titulares de medicamentos homeopáticos a los que se refiere la disposición transitoria sexta del Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente.
Once años después, se aprueba la orden que regula dicho procedimiento y los requisitos para poder realizar la citada comunicación, argumentando en la misma que permitirá poner fin a la situación de transitoriedad en la que se encuentran los médicos homeopáticos, tal y como señala su exposición de motivos. De este modo, los titulares de los medicamentos homeopáticos “dispondrán de un plazo de tres meses a contar desde el día de la entrada en vigor de esta orden para comunicar a la Aemps su intención de adecuarse a lo previsto en el Real Decreto 1345/2007, de 11 de octubre”. De este modo, en agosto próximo habrá finalizado este plazo y todos los productos que quieran seguir comercializados deberán haberse ajustado a lo establecido en dicho real decreto.
A los tres meses de finalizado ese plazo de comunicación, es decir a finales de octubre de 2018, la directora de la Aemps dictará una resolución en la que establecerá “la relación de medicamentos homeopáticos para los que se haya comunicado la intención de adecuación al RD 1345/2007”. Además, fijará un calendario para que los titulares de los citados medicamentos “soliciten la correspondiente autorización de comercialización de acuerdo” a dicho real decreto. En caso de que no se presente dicha solicitud en el plazo establecido “no se podrá seguir comercializando el medicamento en España, debiendo ser retirado del mercado”.
Desde 1994 sin regulación
En nuestro país, conforme a lo establecido en la disposición transitoria segunda del Real Decreto 2208/1994, de 16 de noviembre, por el que se regulan los medicamentos homeopáticos de uso humano de fabricación industrial, pudieron continuar en el mercado aquellos medicamentos homeopáticos que hubiesen presentado la solicitud de autorización y registro correspondiente dentro de los seis meses siguientes a su entrada en vigor.
Con posterioridad, la disposición transitoria sexta del RD 1345/2007, estableció que los medicamentos homeopáticos que se hubiesen acogido a la mencionada disposición transitoria segunda del Real Decreto 2208/1994, de 16 de noviembre, “deberían adecuarse a sus previsiones y que, para ello, los titulares de dichos medicamentos deberían presentar una comunicación en tal sentido ante la Agencia Española de Medicamentos y Productos Sanitarios en los tres meses siguientes a la entrada en vigor de la orden” por la que el Ministerio de Sanidad determinará los requisitos mínimos y el procedimiento para dicha comunicación.
En la orden se establecen los datos que deberá contener la comunicación, requiriendo, entre otros, si el medicamento homeopático reivindica indicación terapéutica o si se solicitará como ‘sin indicaciones terapéuticas’, condiciones de prescripción y dispensación propuestas, composición cualitativa y cuantitativa, requiriendo declaración completa y detallada de los componentes activos del medicamento, forma farmacéutica, así como la declaración de los excipientes e indicación de si el medicamento homeopático está autorizado en algún país de la Unión Europea, con especificación de cuál y de la fecha en la que fue autorizado y registrado.



















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 