INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-SOFOSBUVIR/V1/01112014 (acceda al documento en la web de la Aemps)
Informe de Posicionamiento Terapéutico (IPT) de Sofosbuvir (Sovaldi®)
Fecha de publicación: 18 de noviembre de 2014
Fecha de corrección: 20 de noviembre de 2014 (ver al final)
La infección por el virus de la hepatitis C (VHC) es un problema de salud de primera magnitud en Europa y especialmente en los países mediterráneos, donde la tasas de prevalencia oscilan entre el 1-3%. Es la primera causa de enfermedad hepática terminal y una de las principales indicaciones de trasplante hepático. La recurrencia de la infección en el órgano trasplantado y un curso más agresivo y acelerado hacen que los resultados a medio plazo del trasplante hepático sean peores que los observados en cirrosis de otras etiologías (1)
El VHC se divide en 7 genotipos con numerosos subtipos, siendo el genotipo 1 el más frecuente en Europa con una prevalencia aproximada del 70%, seguido del genotipo 3. En España, el genotipo 4 es el tercero en frecuencia seguido del genotipo 2. El genotipo del VHC, si bien no condiciona una evolución clínica diferente de la hepatitis C crónica (HCC), sí tiene un gran impacto en la respuesta al tratamiento (1)
En el momento actual, los tratamientos aprobados en Europa para la HCC son interferón pegilado (PEG), ribavirina (RBV) y tres inhibidores de la proteasa (IP) NS3/4A: boceprevir (BOC) y telaprevir (TVR), estos últimos activos sólo frente al genotipo 1 y muy recientemente simeprevir (SIM), autorizado para los genotipos 1 y 4. La terapia triple con PEG+RBV y uno de los inhibidores de proteasa están disponibles desde el año 2011 y presentan una tasa de respuesta viral sostenida (RVS) que oscila entre el 30-84% en función de subtipo, el polimorfismo del gen IL28B, la respuesta al tratamiento previo y la gravedad del daño hepático. Para el resto de los genotipos, el tratamiento consiste en la combinación de PEG+RBV durante 16-48 semanas. Las tasas de RVS oscilan entre el 30 y el 80%, siendo en los genotipos 2 y 3 en los que se consiguen mejores resultados (2)
Los tratamientos basados en interferón (IFN) se asocian a un gran número de efectos adversos, especialmente en los pacientes con hepatopatías más avanzadas, lo que limita su aplicabilidad en algunos grupos de pacientes. Estos efectos adversos incluyen riesgo de descompensación hepática, sepsis y mielosupresión grave. Los efectos adversos psiquiátricos de tipo ansioso-depresivo y el insomnio son también frecuentes (3,4)
Por lo tanto, las moderadas tasas de eficacia y la gran cantidad de efectos secundarios de las terapias basadas en interferón, especialmente en los pacientes con enfermedad hepática más avanzada y en los que han fracasado tratamientos previos, hace muy necesarios otros fármacos que sean mejor tolerados, más efectivos y que permitan combinaciones libres de interferón (5-9)
En el momento actual existe un enorme desarrollo de la investigación de nuevos fármacos frente al VHC que actúan de manera directa y pertenecen a 4 clases diferentes: los inhibidores de proteasa NS3/4A, los inhibidores de NS5A y los inhibidores de la polimerasa NS5B que pueden ser nucleósidos o nucleótidos. Todas estos nuevas moléculas se están estudiando en diversas combinaciones (incluyendo o no PEG y/o RBV) entre agentes de las diferentes clases, observándose aumentos muy importantes en la eficacia y de seguridad (3).
SOFOSBUVIR (SOVALDI®)
Sofosbuvir (SOF) ha sido autorizado para el tratamiento de la HCC en adultos en combinación con otros fármacos activos frente al VHC. Se presenta en comprimidos recubiertos con película que contienen 400mg del medicamento. La dosis recomendada es 400mg (1 comprimido) al día y debe tomarse con alimentos (10,11).
Farmacología
SOF es un inhibidor nucleótido de la polimerasa NS5B utilizado en combinación con otros fármacos activos frente al VHC en función del genotipo (ver Tabla 1)
SOF es un profármaco de 2´deoxi-2´-fluoro—2´-C-metiluridina monofosfato que es fosforilado intracelularmente a la forma activa trifosfato. El nucleósido trifosfato es un análogo de UTP que compite por la incorporación a la zona activa de la NS5B polimerasa del VHC. La síntesis del ARN viral se inhibe secundariamente a la incorporación del metabolito fosforilado a la cadena del ARN viral naciente producido por la ARN-polimerasa ARN-dependiente
Se dispone de un total de 22 estudios del desarrollo farmacológico clínico de SOF, 13 estudios en la fase I, 5 estudios en la fase II y 4 estudios en la fase III.
Posología
Tabla 1. Medicamentos recomendados para administración concomitante y duración del tratamiento para la terapia combinada con Sovaldi®. * Incluye pacientes coinfectados por el virus de la inmunodeficiencia humana (VIH). ** Pacientes con enfermedad hepática compensada sin contraindicaciones al IFN (1).
| Población de pacientes* | Tratamiento | Duración |
| Genotipos 1, 4, 5 ó 6 | Sofosbuvir + ribavirina +peginterferón alfa | 12 semanas a, b |
| Genotipos 1, 4, 5 ó 6 | Sofosbuvir + ribavirina Solo para uso en pacientes que no son candidatos ono toleran el tratamientocon peginterferón alfa | 24 semanas |
| Genotipo 2 | Sofosbuvir + ribavirina | 12 semanas b |
| Genotipo 3 | Sofosbuvir + ribavirina +peginterferón alfa | 12 semanas b |
| Genotipo 3 | Sofosbuvir + ribavirina | 24 semanas |
| Pacientes en lista de espera de trasplante hepático | Sofosbuvir + ribavirina | Hasta el trasplante hepático c (mínimo 12 semanas) |
| Pacientes en lista de espera de trasplante hepático | Sofosbuvir + ribavirina +peginterferón alfa** | 12 semanas a, b |
a. Para pacientes con tratamiento previo e infección por el VHC de genotipo 1 y 4-6, no existen datos con la combinación de sofosbuvir, ribavirina y peginterferón.
b. Se debe contemplar la posible ampliación de la duración del tratamiento más allá de
12 semanas y hasta 24 semanas especialmente para los subgrupos que tienen uno o más factores históricamente asociados a menores tasas de respuesta a los tratamientos con
interferón (p. ej. fibrosis/cirrosis avanzada, elevadas concentraciones virales basales, raza negra, genotipo IL28B no CC, previa respuesta nula al tratamiento con peginterferón alfa y ribavirina).
c. Ver "Poblaciones especiales de pacientes. Pacientes en espera de trasplante hepático" más adelante.
Eficacia
La eficacia de SOF ha sido evaluada en un estudio de fase III junto a PEG y RBV en pacientes con VHC genotipos 1,4,5 ó 6 no tratados previamente y en cuatro estudios de fase III junto con RBV y sin PEG en pacientes con VHC genotipo 2 ó 3 tratados y no tratados previamente (2).
La variable principal de eficacia en la mayoría de los estudios es la respuesta viral sostenida en la semana 12 tras finalizar el tratamiento (RSV12).
Genotipo 1, 4-6 en pacientes sin tratamiento previo
Estudio NEUTRINO
Estudio de Fase III, abierto, multicéntrico de brazo único para investigar la eficacia de sofosbuvir 400mg/día junto con interferón pegilado alfa 2a 180 μg subcutáneos/semana y RBV 1000-1200 mg/día durante 12 semanas
Se incluyeron pacientes con infección activa VHC con genotipos 1,4-6, enfermedad hepática compensada, una cifra de plaquetas >90.000/μl y sin coinfección por el virus de la hepatitis B (VHB) o por el virus de la inmunodeficiencia humana (VIH)
El objetivo principal fue la eficacia del tratamiento con SOF + PEG + RBV definida como respuesta viral sostenida en la semana 12 postratamiento (RVS12)
Se incluyeron 327 pacientes con una edad media de 52 años, 64% varones, mayoritariamente de raza blanca. Según genotipo, se incluyeron de VHC genotipo 1a 69%, del 1b 20%, del 4 el 9%, del 5 menos del 1% y del 6 un 2%. Los pacientes con cirrosis hepática compensada estuvieron escasamente representados (16,7%), si bien esta proporción fue superior a la de los ensayos pivotales de TVR o BCV en pacientes naïve genotipo 1. Un 29% de los pacientes presentaba polimorfismo favorable CC del gen IL28B
En el análisis por intención de tratar el 90,5% alcanzaron RVS12. La tasa de RVS fue del 92,7% en pacientes sin cirrosis y del 79,6% en pacientes cirróticos. En el genotipo 1a respuesta fue de 91,6%, en el 1b 83% y en el genotipo 4 del 96%. El único paciente con genotipo 5 y los seis pacientes con genotipo 6 consiguieron RVS. No se produjo ningún rebote viral durante el tratamiento y todos los fallos virológicos fueron recidivas (8,6%). (Tabla 2) El número de abandonos por RAM fue del 2%.
Tabla 2. Estudio NEUTRINO. Porcentaje de pacientes con RVS12 estratificado por genotipo, presencia de cirrosis y polimorfismo del gen IL28B (análisis por ITT)
mg/día y RBV 1.000-1.200mg/día durante 12 semanas frente a PEG 180 μg subcutáneos/semana y RBV 800 mg/día durante 24 semanas. Estudio de no inferioridad con un margen estimado para la diferencia de ─15%
Se incluyeron sujetos con infección activa por VHC genotipo 2,3 sin tratamiento previo, con cirrosis compensada y sin cirrosis y con una albúmina >3,2 g/L, y plaquetas >75.000/μl y sin coinfección por VHB o VIH
El objetivo principal fue la eficacia del tratamiento con SOF + RBV comparada con el estándar de tratamiento (PEG + RBV) valorada mediante RVS12
Se incluyeron 499 pacientes con una edad media de 48 años, 65,5% varones, mayoritariamente de raza blanca y con sobrepeso (IMC medio de 28 kg/m2). El 71,9% tenían VHC genotipo 3, el 27,5% genotipo 2 y tres pacientes incluidos erróneamente tenían genotipo 1 en el grupo de SOF+RBV. La proporción de IL28B CC fue superior al 40% en todos los genotipos para ambos brazos del estudio. La viremia basal VHC fue >6 log UI/ml en el 57% de los pacientes y una baja proporción de enfermos tenían cirrosis hepática compensada (20%)
La combinación de SOF + RBV durante 12 semanas mostró ser no inferior a la biterapia con PEG + RBV durante 24 semanas en pacientes naïve, con unos porcentajes de RVS12 muy similares para ambos tratamientos. Los análisis de subgrupos muestran que, en genotipo 2, la combinación de SOF + RBV durante 12 semanas consigue mayores tasas de RVS12 semanas que PEG + RBV durante 24 semanas. (Tabla 3) No se produjo ningún rebote viral durante el tratamiento y todos los fallos virológicos fueron recidivas (30,1% SOF + RBV vs
21,2% PEG + RBV).
Tabla 3. Estudio FISSION. Porcentaje de pacientes con RVS12 estratificado por genotipo y presencia de cirrosis (análisis por ITT)
Estudio SPARE
Estudio de Fase II, que incluyó 60 pacientes con factores de mal pronóstico (83% raza negra, 81% polimorfismo del gen IL28 no CC, 23% F3-F4.) Los resultados muestran que SOF + RBV ajustada en función del peso (1.000 ó 1.200 mg/día) durante 12 semanas, alcanza una tasa de RVS12 del 68% en pacientes infectados por el VHC genotipo 1. Este estudio también muestra que la combinación de SOF + RBV a dosis bajas (600 mg/día) resulta en una tasa de RVS12 inferior (48%) en comparación con SOF + RBV ajustada en función del peso.
Genotipo 2 y 3 en pacientes sin tratamiento previo (Estudio
FISSION)
Estudio de fase III, multicéntrico, aleatorizado, abierto, controlado para evaluar la eficacia y seguridad de sofosbuvir 400
Genotipo 2,3 en pacientes intolerantes a interferón, inelegibles para interferón o que se negasen a recibir interferón (Estudio POSITRÓN)
Estudio de fase III multicéntrico, aleatorizado, controlado con placebo, doble ciego, para evaluar la eficacia y seguridad de SOF 400mg/día y RBV 1.000-1.200mg/día durante 12 semanas
Se incluyeron pacientes con infección activa por VHC con genotipo 2,3 que no tolerasen interferón (tratamiento previo con interferón de menos de 12 semanas por problemas de efectos adversos/intolerabilidad), que tuviesen una contraindicación para interferón o que se negasen a recibirlo. Los pacientes debían tener una cifra de plaquetas >25.000/μl, albúmina >30 g/L, carecer de antecedentes de descompensación hepática y sin coinfección por VHB o VIH
El objetivo principal del estudio fue la eficacia del tratamiento con SOF + RBV durante 12 semanas valorada como RVS12 comparado con placebo. Se estratificó por ausencia o presencia de cirrosis
Se incluyeron 278 pacientes con una edad media de 52 años, 54% varones, mayoritariamente de raza blanca y con un tercio de los pacientes obesos. Según genotipo, el 51,4% eran genotipo 2 y el 48,6% restante genotipo 3. En cuanto al uso de interferón, el 43,5% eran inelegibles para interferón, el 9% intolerantes y el 47% pacientes que no habían aceptado previamente terapias con interferón. La viremia basal VHC era superior a 6 log UI/ml en el 69,8% de los pacientes. El 45,3% tenían polimorfismo favorable CC En pacientes que no han respondido a un tratamiento previo basado en interferón, la prolongación del tratamiento de SOF + RBV a 16 semanas incrementó de forma significativa la RVS12. El 49,5% de los sujetos del grupo de SOF + RBV durante 12 semanas y 71,4% del grupo de SOF + RBV durante 16 semanas alcanzaron RVS12 (Tabla 5).
Tabla 5: Tasas de RVS12 por genotipo y resultados para los sujetos sin RVS12 en el ensayo FUSION
del gen IL28B y el número de cirróticos era escaso (16%). El 81% no había recibido tratamiento previo para VHC
En el análisis por intención de tratar 77,8% (IC 95% 71,5%- 83,2%) alcanzaron RVS12 frente a 0% en el brazo de placebo. Según genotipo, el 92,7% de los pacientes con genotipo 2 y el 61,2% de los pacientes con genotipo 3 alcanzaron RVS12. No se produjo ningún rebote viral durante el tratamiento y todos los fallos virológicos fueron recidivas (20,5%). Los análisis de subgrupos muestran que, en pacientes con genotipo 2, independientemente de la existencia o a.
semanas (n=103)
semanas (n=98)
no de cirrosis y del tipo de paciente, la combinación de SOF + RBV durante 12 semanas consigue tasas de RVS12 elevadas, lo que no se observa en pacientes con genotipo 3 (Tabla 4).
Tabla 4: Tasas de RVS12 para subgrupos seleccionados por presencia de cirrosis y por clasificación en cuanto al INF en el ensayo POSITRON
El análisis de la eficacia incluye a 6 sujetos con infección por el VHC de genotipo recombinante 2/1.
b. El denominador para la recaída es el número de sujetos con ARN del VHC <LIdC en su última evaluación durante el tratamiento.
c. Otros incluye a los sujetos que no lograron una RVS12 y no reunieron los criterios de fracaso virológico (p. ej., perdidos para el seguimiento).
Los análisis de subgrupos sugieren que la prolongación del tratamiento a 16 semanas con SOF + RBV podría conseguir mayores tasas de RVS12 en pacientes con genotipo 3 y en pacientes cirróticos (Tabla 6).
Tabla 6: Tasas de RVS12 para subgrupos seleccionados por genotipo en el ensayo
FUSION
Genotipo 2,3 en pacientes pre-tratados
Estudio FUSION
Estudio de fase III, multicéntrico, aleatorizado, doble ciego para investigar la eficacia y seguridad de SOF 400 mg/día + RBV 1.000- 1.200 mg/día durante 12 ó 16 semanas
Se incluyeron pacientes con infección activa por VHC genotipo 2 ó 3 que no hubiesen respondido a un tratamiento previo basado en interferón. Debían tener una cifra de plaquetas >50.000/μl, albúmina >30 g/L y carecer de historia de descompensación hepática, sin coinfección por VHB o VIH
El objetivo principal del estudio fue determinar la eficacia del tratamiento con SOF + RBV en cada grupo de tratamiento definida como la proporción de sujetos con RVS12
La aleatorización se realizó de forma central mediante un sistema interactivo por web con un ratio 1:1 y los sujetos se estratificaron por genotipo y por la presencia o ausencia de cirrosis
Se incluyeron 202 pacientes con una edad media de 54 años, 69,7% varones, mayoritariamente blancos y con una elevada proporción de pacientes con sobrepeso u obesidad. El 63,2% tenían VHC genotipo 3, 33,8% genotipo 2 y 3% tuvieron genotipo 1 (que se incluyeron por error en el reclutamiento); el 30,3% eran genotipo CC de IL28B. El porcentaje de pacientes con ARN-VHC≥800.000 UI/ml fue del 78%. Un 34% presentaban cirrosis. El tipo de fracaso al tratamiento previo con PEG/RBV fue un 75,1% de pacientes en recidiva y un 24,9% no respondedores. Todas las características basales estuvieron bien balanceadas entre los dos genotipos y entre los dos grupos de tratamiento.
Estudio LONESTAR-2
Como soporte al ensayo FUSION, se presentaron los resultados de un estudio abierto de fase II en curso, que evalúa la eficacia y seguridad del tratamiento con SOF + PEG + RBV durante 12 semanas en sujetos pretratados con PEG + RBV y con genotipo 2 o 3, la mitad de los cuales tienen cirrosis. Los datos preliminares (47 pacientes evaluados) muestran una alta tasa de RVS12, tanto en pacientes con VHC genotipo 2 (96%), como con genotipo 3, (83,3%), independientemente de la presencia o no de cirrosis hepática.
Genotipo 2 y 3 en pacientes sin tratamiento previo o pre- tratados (Estudio VALENCE)
Estudio de fase III, multicéntrico, aleatorizado, doble ciego para investigar la eficacia y seguridad de SOF 400 mg/día + RBV 1.000- 1.200 mg/día durante 12 (genotipos 2 y 3) ó 24 semanas (genotipo 3) vs. placebo
Se incluyeron pacientes con infección activa por VHC genotipo 2 ó 3 sin tratamiento previo o que no hubiesen respondido a un tratamiento previo basado en interferón, con y sin cirrosis
El objetivo principal del estudio fue determinar la eficacia del tratamiento con SOF+RBV en cada grupo de tratamiento definida como la proporción de sujetos con RVS12
Se incluyeron 419 pacientes con una edad media de 51 años, 59,7% varones, mayoritariamente blancos. La mayoría de los tenían VHC genotipo 3 (78,3%); el 32,5% eran genotipo CC de IL28B. El 73% de los pacientes tenían una viremia basal >6,4 log UI/mL. Un 21% de los pacientes eran cirróticos. De los pacientes pre-tratados, el 29,8% eran no respondedores y el 64.9% eran recaedores
Tras los resultados del estudio FUSION, en base a los resultados emergentes que indicaban una duración de tratamiento insuficiente con SOF + RBV durante 12 semanas, en los pacientes infectados por VHC genotipo 3, el protocolo fue modificado. Se abrió el doble- ciego y todos los pacientes con genotipo 3 recibieron tratamiento durante 24 semanas. Se eliminó el grupo placebo de los pacientes con genotipo 2 y los objetivos del estudio se modificaron sin incluir los cálculos estadísticos para ver si se cumplía la hipótesis inicial y se daban simplemente resultados descriptivos. En base a esto, finalmente 11 pacientes con genotipo 3 recibieron 12 semanas de tratamiento frente a 250que recibieron 24 semanas
En el análisis por intención de tratar, 93,2% (IC95% 84,7%─97,7%) de los pacientes con genotipo 2 tratados durante 12 semanas alcanzaron RVS12, siendo estos resultados consistentes con los resultados observados en los estudios de fase III pivotales. En el grupo de pacientes con genotipo 3 que recibieron 12 semanas de tratamiento, la tasa de respuesta fue del 27,3%, con un rebote viral en el 54,5% de los pacientes. En el grupo de pacientes con VHC genotipo 3 tratados durante 24 semanas, la tasa de respuesta global fue del 84%. (IC95% 78,9%─88,3%). La tasa de rebote viral en este caso fue del 13,6%. La presencia de cirrosis no se relacionó con una menor respuesta viral sostenida en pacientes naïve. En pacientes no respondedores a un tratamiento previo la tasa de RVS12 fue del 87% en pacientes sin cirrosis vs. 62% en pacientes cirróticos. Globalmente, la tasa de RVS12 en pacientes con genotipo 3 tratados durante 24 semanas fue del 91% en no cirróticos y 68% en cirróticos. (Tabla 7)
Tabla 7. Tasas de respuesta por genotipo y resultados para los sujetos sin RVS12 en el ensayo VALENCE
| Genotipo 2SOF + RBV12 semanas(n=73) | Genotipo 3SOF + RBV12 semanas(n=11) | Genotipo 3SOF + RBV24 semanas(n=250) | |
| RVS12 global | 93% (68/73) | 27% (3/11) | 84% (210/250) |
| Resultado para los sujetos sin RVS12 | |||
| Fracaso virológico durante el tratamiento | 0% (0/73) | 0% (0/11) | 0,4% (1/250) |
| Recaída a | 7% (5/73) | 55% (6/11) | 14% (34/249) |
| Otros b | 0% (0/73) | 18% (2/11) | 2% (5/250) |
a. El denominador para la recaída es el número de sujetos con ARN del VHC <LIdC en su última evaluación durante el tratamiento.
b. Otros incluye a los sujetos que no lograron una RVS12 y no reunieron los criterios de fracaso virológico (p. ej., perdidos para el seguimiento).
Sofosbuvir en poblaciones especiales
Pacientes en lista de espera de trasplante hepático (Estudio
P7977-2025)
INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-SOFOSBUVIR/V1/01112014 (acceda al documento en la web de la Aemps)
Informe de Posicionamiento Terapéutico (IPT) de Sofosbuvir (Sovaldi®)
Fecha de publicación: 18 de noviembre de 2014
Fecha de corrección: 20 de noviembre de 2014 (ver al final)
La infección por el virus de la hepatitis C (VHC) es un problema de salud de primera magnitud en Europa y especialmente en los países mediterráneos, donde la tasas de prevalencia oscilan entre el 1-3%. Es la primera causa de enfermedad hepática terminal y una de las principales indicaciones de trasplante hepático. La recurrencia de la infección en el órgano trasplantado y un curso más agresivo y acelerado hacen que los resultados a medio plazo del trasplante hepático sean peores que los observados en cirrosis de otras etiologías (1)
El VHC se divide en 7 genotipos con numerosos subtipos, siendo el genotipo 1 el más frecuente en Europa con una prevalencia aproximada del 70%, seguido del genotipo 3. En España, el genotipo 4 es el tercero en frecuencia seguido del genotipo 2. El genotipo del VHC, si bien no condiciona una evolución clínica diferente de la hepatitis C crónica (HCC), sí tiene un gran impacto en la respuesta al tratamiento (1)
En el momento actual, los tratamientos aprobados en Europa para la HCC son interferón pegilado (PEG), ribavirina (RBV) y tres inhibidores de la proteasa (IP) NS3/4A: boceprevir (BOC) y telaprevir (TVR), estos últimos activos sólo frente al genotipo 1 y muy recientemente simeprevir (SIM), autorizado para los genotipos 1 y 4. La terapia triple con PEG+RBV y uno de los inhibidores de proteasa están disponibles desde el año 2011 y presentan una tasa de respuesta viral sostenida (RVS) que oscila entre el 30-84% en función de subtipo, el polimorfismo del gen IL28B, la respuesta al tratamiento previo y la gravedad del daño hepático. Para el resto de los genotipos, el tratamiento consiste en la combinación de PEG+RBV durante 16-48 semanas. Las tasas de RVS oscilan entre el 30 y el 80%, siendo en los genotipos 2 y 3 en los que se consiguen mejores resultados (2)
Los tratamientos basados en interferón (IFN) se asocian a un gran número de efectos adversos, especialmente en los pacientes con hepatopatías más avanzadas, lo que limita su aplicabilidad en algunos grupos de pacientes. Estos efectos adversos incluyen riesgo de descompensación hepática, sepsis y mielosupresión grave. Los efectos adversos psiquiátricos de tipo ansioso-depresivo y el insomnio son también frecuentes (3,4)
Por lo tanto, las moderadas tasas de eficacia y la gran cantidad de efectos secundarios de las terapias basadas en interferón, especialmente en los pacientes con enfermedad hepática más avanzada y en los que han fracasado tratamientos previos, hace muy necesarios otros fármacos que sean mejor tolerados, más efectivos y que permitan combinaciones libres de interferón (5-9)
En el momento actual existe un enorme desarrollo de la investigación de nuevos fármacos frente al VHC que actúan de manera directa y pertenecen a 4 clases diferentes: los inhibidores de proteasa NS3/4A, los inhibidores de NS5A y los inhibidores de la polimerasa NS5B que pueden ser nucleósidos o nucleótidos. Todas estos nuevas moléculas se están estudiando en diversas combinaciones (incluyendo o no PEG y/o RBV) entre agentes de las diferentes clases, observándose aumentos muy importantes en la eficacia y de seguridad (3).
SOFOSBUVIR (SOVALDI®)
Sofosbuvir (SOF) ha sido autorizado para el tratamiento de la HCC en adultos en combinación con otros fármacos activos frente al VHC. Se presenta en comprimidos recubiertos con película que contienen 400mg del medicamento. La dosis recomendada es 400mg (1 comprimido) al día y debe tomarse con alimentos (10,11).
Farmacología
SOF es un inhibidor nucleótido de la polimerasa NS5B utilizado en combinación con otros fármacos activos frente al VHC en función del genotipo (ver Tabla 1)
SOF es un profármaco de 2´deoxi-2´-fluoro—2´-C-metiluridina monofosfato que es fosforilado intracelularmente a la forma activa trifosfato. El nucleósido trifosfato es un análogo de UTP que compite por la incorporación a la zona activa de la NS5B polimerasa del VHC. La síntesis del ARN viral se inhibe secundariamente a la incorporación del metabolito fosforilado a la cadena del ARN viral naciente producido por la ARN-polimerasa ARN-dependiente
Se dispone de un total de 22 estudios del desarrollo farmacológico clínico de SOF, 13 estudios en la fase I, 5 estudios en la fase II y 4 estudios en la fase III.
Posología
Tabla 1. Medicamentos recomendados para administración concomitante y duración del tratamiento para la terapia combinada con Sovaldi®. * Incluye pacientes coinfectados por el virus de la inmunodeficiencia humana (VIH). ** Pacientes con enfermedad hepática compensada sin contraindicaciones al IFN (1).
| Población de pacientes* | Tratamiento | Duración |
| Genotipos 1, 4, 5 ó 6 | Sofosbuvir + ribavirina +peginterferón alfa | 12 semanas a, b |
| Genotipos 1, 4, 5 ó 6 | Sofosbuvir + ribavirina Solo para uso en pacientes que no son candidatos ono toleran el tratamientocon peginterferón alfa | 24 semanas |
| Genotipo 2 | Sofosbuvir + ribavirina | 12 semanas b |
| Genotipo 3 | Sofosbuvir + ribavirina +peginterferón alfa | 12 semanas b |
| Genotipo 3 | Sofosbuvir + ribavirina | 24 semanas |
| Pacientes en lista de espera de trasplante hepático | Sofosbuvir + ribavirina | Hasta el trasplante hepático c (mínimo 12 semanas) |
| Pacientes en lista de espera de trasplante hepático | Sofosbuvir + ribavirina +peginterferón alfa** | 12 semanas a, b |
a. Para pacientes con tratamiento previo e infección por el VHC de genotipo 1 y 4-6, no existen datos con la combinación de sofosbuvir, ribavirina y peginterferón.
b. Se debe contemplar la posible ampliación de la duración del tratamiento más allá de
12 semanas y hasta 24 semanas especialmente para los subgrupos que tienen uno o más factores históricamente asociados a menores tasas de respuesta a los tratamientos con
interferón (p. ej. fibrosis/cirrosis avanzada, elevadas concentraciones virales basales, raza negra, genotipo IL28B no CC, previa respuesta nula al tratamiento con peginterferón alfa y ribavirina).
c. Ver "Poblaciones especiales de pacientes. Pacientes en espera de trasplante hepático" más adelante.
Eficacia
La eficacia de SOF ha sido evaluada en un estudio de fase III junto a PEG y RBV en pacientes con VHC genotipos 1,4,5 ó 6 no tratados previamente y en cuatro estudios de fase III junto con RBV y sin PEG en pacientes con VHC genotipo 2 ó 3 tratados y no tratados previamente (2).
La variable principal de eficacia en la mayoría de los estudios es la respuesta viral sostenida en la semana 12 tras finalizar el tratamiento (RSV12).
Genotipo 1, 4-6 en pacientes sin tratamiento previo
Estudio NEUTRINO
Estudio de Fase III, abierto, multicéntrico de brazo único para investigar la eficacia de sofosbuvir 400mg/día junto con interferón pegilado alfa 2a 180 μg subcutáneos/semana y RBV 1000-1200 mg/día durante 12 semanas
Se incluyeron pacientes con infección activa VHC con genotipos 1,4-6, enfermedad hepática compensada, una cifra de plaquetas >90.000/μl y sin coinfección por el virus de la hepatitis B (VHB) o por el virus de la inmunodeficiencia humana (VIH)
El objetivo principal fue la eficacia del tratamiento con SOF + PEG + RBV definida como respuesta viral sostenida en la semana 12 postratamiento (RVS12)
Se incluyeron 327 pacientes con una edad media de 52 años, 64% varones, mayoritariamente de raza blanca. Según genotipo, se incluyeron de VHC genotipo 1a 69%, del 1b 20%, del 4 el 9%, del 5 menos del 1% y del 6 un 2%. Los pacientes con cirrosis hepática compensada estuvieron escasamente representados (16,7%), si bien esta proporción fue superior a la de los ensayos pivotales de TVR o BCV en pacientes naïve genotipo 1. Un 29% de los pacientes presentaba polimorfismo favorable CC del gen IL28B
En el análisis por intención de tratar el 90,5% alcanzaron RVS12. La tasa de RVS fue del 92,7% en pacientes sin cirrosis y del 79,6% en pacientes cirróticos. En el genotipo 1a respuesta fue de 91,6%, en el 1b 83% y en el genotipo 4 del 96%. El único paciente con genotipo 5 y los seis pacientes con genotipo 6 consiguieron RVS. No se produjo ningún rebote viral durante el tratamiento y todos los fallos virológicos fueron recidivas (8,6%). (Tabla 2) El número de abandonos por RAM fue del 2%.
Tabla 2. Estudio NEUTRINO. Porcentaje de pacientes con RVS12 estratificado por genotipo, presencia de cirrosis y polimorfismo del gen IL28B (análisis por ITT)
mg/día y RBV 1.000-1.200mg/día durante 12 semanas frente a PEG 180 μg subcutáneos/semana y RBV 800 mg/día durante 24 semanas. Estudio de no inferioridad con un margen estimado para la diferencia de ─15%
Se incluyeron sujetos con infección activa por VHC genotipo 2,3 sin tratamiento previo, con cirrosis compensada y sin cirrosis y con una albúmina >3,2 g/L, y plaquetas >75.000/μl y sin coinfección por VHB o VIH
El objetivo principal fue la eficacia del tratamiento con SOF + RBV comparada con el estándar de tratamiento (PEG + RBV) valorada mediante RVS12
Se incluyeron 499 pacientes con una edad media de 48 años, 65,5% varones, mayoritariamente de raza blanca y con sobrepeso (IMC medio de 28 kg/m2). El 71,9% tenían VHC genotipo 3, el 27,5% genotipo 2 y tres pacientes incluidos erróneamente tenían genotipo 1 en el grupo de SOF+RBV. La proporción de IL28B CC fue superior al 40% en todos los genotipos para ambos brazos del estudio. La viremia basal VHC fue >6 log UI/ml en el 57% de los pacientes y una baja proporción de enfermos tenían cirrosis hepática compensada (20%)
La combinación de SOF + RBV durante 12 semanas mostró ser no inferior a la biterapia con PEG + RBV durante 24 semanas en pacientes naïve, con unos porcentajes de RVS12 muy similares para ambos tratamientos. Los análisis de subgrupos muestran que, en genotipo 2, la combinación de SOF + RBV durante 12 semanas consigue mayores tasas de RVS12 semanas que PEG + RBV durante 24 semanas. (Tabla 3) No se produjo ningún rebote viral durante el tratamiento y todos los fallos virológicos fueron recidivas (30,1% SOF + RBV vs
21,2% PEG + RBV).
Tabla 3. Estudio FISSION. Porcentaje de pacientes con RVS12 estratificado por genotipo y presencia de cirrosis (análisis por ITT)
Estudio SPARE
Estudio de Fase II, que incluyó 60 pacientes con factores de mal pronóstico (83% raza negra, 81% polimorfismo del gen IL28 no CC, 23% F3-F4.) Los resultados muestran que SOF + RBV ajustada en función del peso (1.000 ó 1.200 mg/día) durante 12 semanas, alcanza una tasa de RVS12 del 68% en pacientes infectados por el VHC genotipo 1. Este estudio también muestra que la combinación de SOF + RBV a dosis bajas (600 mg/día) resulta en una tasa de RVS12 inferior (48%) en comparación con SOF + RBV ajustada en función del peso.
Genotipo 2 y 3 en pacientes sin tratamiento previo (Estudio
FISSION)
Estudio de fase III, multicéntrico, aleatorizado, abierto, controlado para evaluar la eficacia y seguridad de sofosbuvir 400
Genotipo 2,3 en pacientes intolerantes a interferón, inelegibles para interferón o que se negasen a recibir interferón (Estudio POSITRÓN)
Estudio de fase III multicéntrico, aleatorizado, controlado con placebo, doble ciego, para evaluar la eficacia y seguridad de SOF 400mg/día y RBV 1.000-1.200mg/día durante 12 semanas
Se incluyeron pacientes con infección activa por VHC con genotipo 2,3 que no tolerasen interferón (tratamiento previo con interferón de menos de 12 semanas por problemas de efectos adversos/intolerabilidad), que tuviesen una contraindicación para interferón o que se negasen a recibirlo. Los pacientes debían tener una cifra de plaquetas >25.000/μl, albúmina >30 g/L, carecer de antecedentes de descompensación hepática y sin coinfección por VHB o VIH
El objetivo principal del estudio fue la eficacia del tratamiento con SOF + RBV durante 12 semanas valorada como RVS12 comparado con placebo. Se estratificó por ausencia o presencia de cirrosis
Se incluyeron 278 pacientes con una edad media de 52 años, 54% varones, mayoritariamente de raza blanca y con un tercio de los pacientes obesos. Según genotipo, el 51,4% eran genotipo 2 y el 48,6% restante genotipo 3. En cuanto al uso de interferón, el 43,5% eran inelegibles para interferón, el 9% intolerantes y el 47% pacientes que no habían aceptado previamente terapias con interferón. La viremia basal VHC era superior a 6 log UI/ml en el 69,8% de los pacientes. El 45,3% tenían polimorfismo favorable CC En pacientes que no han respondido a un tratamiento previo basado en interferón, la prolongación del tratamiento de SOF + RBV a 16 semanas incrementó de forma significativa la RVS12. El 49,5% de los sujetos del grupo de SOF + RBV durante 12 semanas y 71,4% del grupo de SOF + RBV durante 16 semanas alcanzaron RVS12 (Tabla 5).
Tabla 5: Tasas de RVS12 por genotipo y resultados para los sujetos sin RVS12 en el ensayo FUSION
del gen IL28B y el número de cirróticos era escaso (16%). El 81% no había recibido tratamiento previo para VHC
En el análisis por intención de tratar 77,8% (IC 95% 71,5%- 83,2%) alcanzaron RVS12 frente a 0% en el brazo de placebo. Según genotipo, el 92,7% de los pacientes con genotipo 2 y el 61,2% de los pacientes con genotipo 3 alcanzaron RVS12. No se produjo ningún rebote viral durante el tratamiento y todos los fallos virológicos fueron recidivas (20,5%). Los análisis de subgrupos muestran que, en pacientes con genotipo 2, independientemente de la existencia o a.
semanas (n=103)
semanas (n=98)
no de cirrosis y del tipo de paciente, la combinación de SOF + RBV durante 12 semanas consigue tasas de RVS12 elevadas, lo que no se observa en pacientes con genotipo 3 (Tabla 4).
Tabla 4: Tasas de RVS12 para subgrupos seleccionados por presencia de cirrosis y por clasificación en cuanto al INF en el ensayo POSITRON
El análisis de la eficacia incluye a 6 sujetos con infección por el VHC de genotipo recombinante 2/1.
b. El denominador para la recaída es el número de sujetos con ARN del VHC <LIdC en su última evaluación durante el tratamiento.
c. Otros incluye a los sujetos que no lograron una RVS12 y no reunieron los criterios de fracaso virológico (p. ej., perdidos para el seguimiento).
Los análisis de subgrupos sugieren que la prolongación del tratamiento a 16 semanas con SOF + RBV podría conseguir mayores tasas de RVS12 en pacientes con genotipo 3 y en pacientes cirróticos (Tabla 6).
Tabla 6: Tasas de RVS12 para subgrupos seleccionados por genotipo en el ensayo
FUSION
Genotipo 2,3 en pacientes pre-tratados
Estudio FUSION
Estudio de fase III, multicéntrico, aleatorizado, doble ciego para investigar la eficacia y seguridad de SOF 400 mg/día + RBV 1.000- 1.200 mg/día durante 12 ó 16 semanas
Se incluyeron pacientes con infección activa por VHC genotipo 2 ó 3 que no hubiesen respondido a un tratamiento previo basado en interferón. Debían tener una cifra de plaquetas >50.000/μl, albúmina >30 g/L y carecer de historia de descompensación hepática, sin coinfección por VHB o VIH
El objetivo principal del estudio fue determinar la eficacia del tratamiento con SOF + RBV en cada grupo de tratamiento definida como la proporción de sujetos con RVS12
La aleatorización se realizó de forma central mediante un sistema interactivo por web con un ratio 1:1 y los sujetos se estratificaron por genotipo y por la presencia o ausencia de cirrosis
Se incluyeron 202 pacientes con una edad media de 54 años, 69,7% varones, mayoritariamente blancos y con una elevada proporción de pacientes con sobrepeso u obesidad. El 63,2% tenían VHC genotipo 3, 33,8% genotipo 2 y 3% tuvieron genotipo 1 (que se incluyeron por error en el reclutamiento); el 30,3% eran genotipo CC de IL28B. El porcentaje de pacientes con ARN-VHC≥800.000 UI/ml fue del 78%. Un 34% presentaban cirrosis. El tipo de fracaso al tratamiento previo con PEG/RBV fue un 75,1% de pacientes en recidiva y un 24,9% no respondedores. Todas las características basales estuvieron bien balanceadas entre los dos genotipos y entre los dos grupos de tratamiento.
Estudio LONESTAR-2
Como soporte al ensayo FUSION, se presentaron los resultados de un estudio abierto de fase II en curso, que evalúa la eficacia y seguridad del tratamiento con SOF + PEG + RBV durante 12 semanas en sujetos pretratados con PEG + RBV y con genotipo 2 o 3, la mitad de los cuales tienen cirrosis. Los datos preliminares (47 pacientes evaluados) muestran una alta tasa de RVS12, tanto en pacientes con VHC genotipo 2 (96%), como con genotipo 3, (83,3%), independientemente de la presencia o no de cirrosis hepática.
Genotipo 2 y 3 en pacientes sin tratamiento previo o pre- tratados (Estudio VALENCE)
Estudio de fase III, multicéntrico, aleatorizado, doble ciego para investigar la eficacia y seguridad de SOF 400 mg/día + RBV 1.000- 1.200 mg/día durante 12 (genotipos 2 y 3) ó 24 semanas (genotipo 3) vs. placebo
Se incluyeron pacientes con infección activa por VHC genotipo 2 ó 3 sin tratamiento previo o que no hubiesen respondido a un tratamiento previo basado en interferón, con y sin cirrosis
El objetivo principal del estudio fue determinar la eficacia del tratamiento con SOF+RBV en cada grupo de tratamiento definida como la proporción de sujetos con RVS12
Se incluyeron 419 pacientes con una edad media de 51 años, 59,7% varones, mayoritariamente blancos. La mayoría de los tenían VHC genotipo 3 (78,3%); el 32,5% eran genotipo CC de IL28B. El 73% de los pacientes tenían una viremia basal >6,4 log UI/mL. Un 21% de los pacientes eran cirróticos. De los pacientes pre-tratados, el 29,8% eran no respondedores y el 64.9% eran recaedores
Tras los resultados del estudio FUSION, en base a los resultados emergentes que indicaban una duración de tratamiento insuficiente con SOF + RBV durante 12 semanas, en los pacientes infectados por VHC genotipo 3, el protocolo fue modificado. Se abrió el doble- ciego y todos los pacientes con genotipo 3 recibieron tratamiento durante 24 semanas. Se eliminó el grupo placebo de los pacientes con genotipo 2 y los objetivos del estudio se modificaron sin incluir los cálculos estadísticos para ver si se cumplía la hipótesis inicial y se daban simplemente resultados descriptivos. En base a esto, finalmente 11 pacientes con genotipo 3 recibieron 12 semanas de tratamiento frente a 250que recibieron 24 semanas
En el análisis por intención de tratar, 93,2% (IC95% 84,7%─97,7%) de los pacientes con genotipo 2 tratados durante 12 semanas alcanzaron RVS12, siendo estos resultados consistentes con los resultados observados en los estudios de fase III pivotales. En el grupo de pacientes con genotipo 3 que recibieron 12 semanas de tratamiento, la tasa de respuesta fue del 27,3%, con un rebote viral en el 54,5% de los pacientes. En el grupo de pacientes con VHC genotipo 3 tratados durante 24 semanas, la tasa de respuesta global fue del 84%. (IC95% 78,9%─88,3%). La tasa de rebote viral en este caso fue del 13,6%. La presencia de cirrosis no se relacionó con una menor respuesta viral sostenida en pacientes naïve. En pacientes no respondedores a un tratamiento previo la tasa de RVS12 fue del 87% en pacientes sin cirrosis vs. 62% en pacientes cirróticos. Globalmente, la tasa de RVS12 en pacientes con genotipo 3 tratados durante 24 semanas fue del 91% en no cirróticos y 68% en cirróticos. (Tabla 7)
Tabla 7. Tasas de respuesta por genotipo y resultados para los sujetos sin RVS12 en el ensayo VALENCE
| Genotipo 2SOF + RBV12 semanas(n=73) | Genotipo 3SOF + RBV12 semanas(n=11) | Genotipo 3SOF + RBV24 semanas(n=250) | |
| RVS12 global | 93% (68/73) | 27% (3/11) | 84% (210/250) |
| Resultado para los sujetos sin RVS12 | |||
| Fracaso virológico durante el tratamiento | 0% (0/73) | 0% (0/11) | 0,4% (1/250) |
| Recaída a | 7% (5/73) | 55% (6/11) | 14% (34/249) |
| Otros b | 0% (0/73) | 18% (2/11) | 2% (5/250) |
a. El denominador para la recaída es el número de sujetos con ARN del VHC <LIdC en su última evaluación durante el tratamiento.
b. Otros incluye a los sujetos que no lograron una RVS12 y no reunieron los criterios de fracaso virológico (p. ej., perdidos para el seguimiento).
Sofosbuvir en poblaciones especiales
Pacientes en lista de espera de trasplante hepático (Estudio
P7977-2025)
Estudio de Fase II que ha valorado la eficacia de SOF + RBV durante 24-48 semanas o hasta el momento de trasplante para prevenir la recidiva de la hepatitis C después del trasplante hepático (TH). El protocolo inicial contemplaba 24 semanas de tratamiento, que posteriormente se ampliaron a 48 semanas tras observar 11/15 recaídas virales en pacientes que interrumpieron el tratamiento en la semana 24. Eran pacientes en lista de espera de trasplante hepático por cirrosis VHC y carcinoma hepatocelular (CHC) dentro de los criterios de Milán. El objetivo principal fue la prevención de recidiva de la hepatitis C post-TH, definida como la proporción de pacientes con viremia VHC indetectable a la semana 12 post-TH (RVPT) en pacientes que hubieran recibido más de 12 semanas de tratamiento y que tuvieran viremia indetectable en el momento del TH. Se ha realizado un análisis intermedio de resultados en 61 pacientes incluidos que recibieron al menos una dosis de la medicación del estudio
Los pacientes fueron mayoritariamente varones, de raza blanca, con una edad media de 59 años; un 75% habían recibido tratamiento previamente, 74% tenían VHC genotipo 1, 13% genotipo 2, 11,.5% genotipo 3 y 1,6% genotipo 4. La mayoría estaban clínicamente compensados (Child-Pugh A 73%, mediana de MELD 8). De los 61 pacientes analizados, 44 fueron trasplantados y 41 de ellos tenían viremia indetectable en el momento del trasplante (93%). La media del tiempo hasta trasplante fue de 21 semanas (rango: 2─42 semanas). De estos 41 pacientes con viremia indetectable en el momento del trasplante, 37 alcanzaron las 12 semanas postrasplante, y 23 de ellos (62,2%) consiguieron RVPT. De los pacientes a los que se ha trasplantado y han alcanzado las 12 semanas postrasplante, el 69% mantuvo RVS si el tiempo con viremia VHC por debajo del límite de cuantificación antes del TH fue >1 mes frente al 4% de RVS si ese tiempo fue <1 mes.
Trasplante hepático
En un ensayo fase II (Estudio GS-US-334-0126, , no controlado y abierto se ha evaluado la eficacia de SOF + RBV durante 24 semanas en pacientes trasplantados con hepatopatía compensada por recurrencia del virus C (63% F3-F4) (12). La variable principal del mismo es RVS12
El ensayo incluye un total de 40 pacientes. Se ha realizado un análisis preliminar en el que se logró la indetectabilidad del ARN VHC en el 100% de los casos al final del tratamiento, se mantuvo a las 4 semanas una vez concluido el tratamiento en 21 de 26 pacientes evaluados (80,8%) y persistió indetectable en el 70% tras 12 semanas de seguimiento
Se dispone de datos referentes al programa de uso compasivo de sofosbuvir y ribavirina (con o sin interferón pegilado) en pacientes con hepatitis aguda grave (incluyendo hepatitis colestásica fibrosante) y hepatopatía descompensada por recurrencia grave post- transplante. En una cohorte de más de 100 pacientes los datos de RVS12 tras 24─48 semanas de tratamiento son de aproximadamente el 60% objetivándose una mejoría clínica en más de la mitad de los pacientes.
Pacientes con enfermedad hepática avanzada
En un estudio (GS-US-334-0125) llevado a cabo con 25 pacientes con cirrosis y hepatopatía descompensada (Child-Pugh A 36%, B 60%, C 4%; MELD <10 32%, 10-15 56%, >15 12%), mayoritariamente G1 (76%) y previamente tratados (68%), que fueron tratados con SOF + RBV durante 24 semanas, el 100% de los pacientes en estadio Child-Pugh A y 93% de los pacientes en estadio Child-Pugh B presentaron ARN indetectable al final del tratamiento. Globalmente se apreció una mejoría significativa en la cifra de plaquetas y albúmina, aunque no así en INR en comparación con el grupo observación que no recibió tratamiento alguno; la ALT se normalizó en la mayoría. Todo ello se acompañó de una mejoría en los índices MELD y Child-Pugh, sobre todo en los pacientes en estadio Child-Pugh B. Clínicamente, desapareció la ascitis y la encefalopatía en todos los pacientes a partir de la semana 24 de tratamiento. El tratamiento fue bien tolerado, siendo los efectos secundarios más frecuentes astenia, náuseas y prurito.
Pacientes coinfectados por VIH/VHC (PHOTON-1)
Estudio de fase III, abierto, no controlado y multicéntrico para investigar la eficacia de SOF + RBV en pacientes coinfectados con VIH-1 y con HCC genotipo 1-3. Se incluyeron 223 pacientes: los sujetos con HCC genotipos 2 y 3 habían recibido o no tratamientos previos, mientras que los sujetos con HCC genotipo 1 eran todos naïve. El 18% tenían cirrosis compensada. Los pacientes con genotipo 2 ó 3 naïve se trataron 12 semanas y los pre-tratados durante 24 semanas. Los pacientes con genotipo 1 se trataron durante 24 semanas. La mayoría de los pacientes (95%) estaban recibiendo tratamiento antirretroviral
Entre los pacientes con VHC genotipo 1, el 76,3% (87/114) alcanzaron RVS12. Los pacientes con genotipo 2 tratados 12 semanas alcanzaron una tasa de RVS12 del 88% (23/26) y del 93% (22/24) los previamente tratados durante 24 semanas. Los pacientes con genotipo 3 tratados 12 semanas alcanzaron una tasa de RVS12 del 67% (28/42) y los tratados 24 semanas del 92% (12/13).
Seguridad
Los datos de seguridad de SOF se basan en 1.732 pacientes incluidos en los estudios de fase II, III y los estudios en poblaciones especiales (más de 250 de los cuales fueron pacientes con cirrosis compensada). En el grupo de tratamiento de 12 semanas con SOF + RBV se analizaron 622 sujetos, en el de 12 semanas con SOF + PEG + RBV se analizaron 456 sujetos, 98 sujetos con SOF + RBV durante 16 semanas y 421 en con SOF + RBV durante 24 semanas
Las interrupciones por efectos adversos han sido muy bajas en todos los estudios analizados, siendo inferiores al 2% en todos los brazos que incluyeron SOF y del 10,7% en los brazos de PEG + RBV. En el estudio NEUTRINO (brazo único de 12 semanas con SOF + PEG + RBV) la proporción de pacientes que discontinuó por efectos adversos fue del 1,5%, cifra extremadamente baja para una pauta de interferón, probablemente influida por la corta duración del tratamiento y la motivación de los pacientes
En las pautas SOF + RBV los efectos adversos grado ≥3 han sido poco frecuentes y sin diferencias significativas con placebo. Los efectos adversos leves más frecuentes en las ramas de SOF que en las de placebo fueron fatiga, cefalea, náuseas e insomnio, los cuales se sabe que están relacionados con RBV
Los efectos adversos graves (EAG) fueron muy raros, menos de 4% en todos las ramas. Sólo se produjo una muerte, en el estudio FISSION, debido a una sobredosis de cocaína y heroína y ocurrió en el día 1 del estudio. La aparición de carcinoma hepatocelular y celulitis fueron los únicos EAG que ocurrieron en más de un paciente. Los tres casos de carcinoma hepatocelular se produjeron en pacientes cirróticos
El resto de los EAG recogidos no mostraron ninguna tendencia en cuanto a los tipos de eventos ni en cuanto al momento de aparición de los mismos durante el tratamiento
En la pauta SOF + RBV + PEG, los pacientes en tratamiento con SOF experimentaron anemia y neutropenia grado 3 en un 27% y un 15%, respectivamente. El resto de anomalías de laboratorio de grado 3-4 recogidas fueron escasas; el resto de anomalías estuvieron por debajo del 5%. Se observó una proporción más elevada de fatiga, hiporexia, pirexia, mialgias, síndrome pseudogripal, depresión y neutropenia, todos ellos atribuibles a interferón
No se dispone de datos de seguridad con sofosbuvir a largo plazo, por lo que se recomienda precaución.
Seguridad en pacientes con insuficiencia hepática
En los pacientes con cirrosis compensada tratados con SOF + PEG + RBV se observaron tasas más altas de anemia y neutropenia comparados con los pacientes sin cirrosis. Estos hallazgos son similares a los encontrados en otros estudios con PEG + RBV en pacientes cirróticos. Globalmente, la pauta de SOF + RBV fue segura y bien tolerada en esta población y los efectos adversos recogidos fueron los esperados en este tipo de pacientes. No se ha identificado ningún efecto adverso específico relacionado con SOF
Se realizó un estudio específico farmacocinético/ farmacodinámico en estos pacientes y no se demostró la necesidad de hacer ningún ajuste de dosis.
Seguridad en pacientes con insuficiencia renal
En pacientes con enfermedad renal avanzada o terminal hay una acumulación sustancial del metabolito inactivo GS-331007, con un considerable menor efecto que SOF. De todos modos, no existen datos clínicos en estos pacientes y el titular está planeando hacer un estudio específico comparando diferentes dosis.
Seguridad en pacientes con coinfección por VIH
En relación a los pacientes coinfectados no se encontró ningún efecto adverso específico para esta población diferente al resto de los pacientes estudiados. En esta población, SOF + RBV presenta un perfil de seguridad similar al observado en los pacientes monifectados, siendo en general seguro y bien tolerado. 7 pacientes tratados durante 12 semanas y 6 tratados durante 24 semanas experimentaron acontecimientos adversos graves. El número de abandonos por razones de seguridad fue de 4 y 3 pacientes, respectivamente. Los efectos adversos más frecuentes reportados en pacientes co-infectados fueron fatiga, insomnio, dolor de cabeza y náuseas
No parece que SOF interaccione significativamente con los antivirales del tratamiento por infección del VIH a excepción de la coadministración con Tipranavir/ritonavir, que reduce marcadamente los niveles de SOF.
Interacciones
Sofosbuvir interacciona con inductores de la Glicoproteína P (carbamazepina, fenitoína, rifampicina y hierba de San Juan).
DISCUSIÓN
En el momento actual, existen cuatro combinaciones aprobadas y comercializadas para el tratamiento de la hepatitis C crónica en España, PEG + RBV, TVR + PEG + RBV, BOC + PEG + RBV, y SIM + PEG + RBV, cuyas indicaciones dependen del genotipo VHC y de las características de los pacientes. Están en fase de evaluación por las agencias reguladoras o lo estarán en un futuro próximo nuevos fármacos y múltiples combinaciones de los mismos entre sí y/o con los ya disponibles (3)
Sofosbuvir es el primer antiviral directo frente al VHC con actividad antiviral frente a todos los genotipos. Presenta alta potencia antiviral combinada con una alta barrera genética a la resistencia, lo que le permite ser utilizado en múltiples combinaciones, incluyendo pautas libres de interferón. Su tolerabilidad es muy buena, con pocas toxicidades significativas
Como aspectos generales de los ensayos clínicos de fase III, los pacientes incluidos tenían edades medias (50-56 años) quedando escasamente representados los mayores de 65 años; la proporción de mujeres fue adecuada; el porcentaje de pacientes con sobrepeso u obesidad fue alto en todos los ensayos. Es importante destacar que los pacientes con enfermedad hepática en estadios avanzados están escasamente representados y, por tanto, las conclusiones en este grupo de enfermos son menos sólidas. Específicamente, los pacientes con antecedentes de cirrosis descompensada fueron excluidos de todos los ensayos clínicos
Sofosbuvir ha sido aprobado para utilizarse conjuntamente con ribavirina y, en algunos casos, asociado a PEG, con una duración de tratamiento variable. Se debe tener en cuenta que en la mayoría de ensayos clínicos no se ha incluido grupo comparador. Además, algunos de los resultados se basan en grupos de pacientes limitados o en datos preliminares, lo que en algunos casos dificulta poder establecer la duración de tratamiento óptima en función de genotipo, cirrosis, tratamiento previo, etc. o en poblaciones especiales. Sin embargo, también es importante destacar que en los ensayos clínicos descritos anteriormente, sofosbuvir ha demostrado unos buenos datos de tasa de respuesta y un beneficio clínico añadido en comparación con la terapia estándar en base a un perfil de seguridad más favorable, unido a la posibilidad de acortamiento en la duración del tratamiento a 12 semanas en muchos casos y al hecho de que puede ser usado sin PEG en determinados grupos de pacientes. El perfil de efectos secundarios descritos con la combinación de SOF con RBV ± PEG son los típicos de RBV y PEG, sin incrementar sustancialmente ni su frecuencia ni su gravedad. De hecho, el acortamiento de la duración del tratamiento asociado al uso de SOF redunda en una mejor tolerabilidad de los efectos secundarios de PEG y RBV
Por otro lado, en poblaciones especiales (trasplantados y coinfectados por VIH) los datos son limitados. Sin embargo, los resultados obtenidos en coinfectados son consistentes con los de la población general de monoinfectados estudiada, lo que nos permite hacer las mismas recomendaciones para esta población. En cuanto a pacientes con enfermedad avanzada (incluidos pacientes en lista de espera de trasplante hepático y postrasplantados) el beneficio observado con las combinaciones de fármacos libres de interferón que incluyen sofosbuvir, bien en términos de RVS o en tolerabilidad, es significativo. Esto unido a que en estos pacientes las opciones terapéuticas son escasas, subóptimas y, en algunos casos, nulas y a que en muchos casos la necesidad de tratamiento es urgente, permite hacer recomendaciones de tratamiento en estas poblaciones pese a lo limitado de los datos (6-8)
Sofosbuvir ha sido utilizado en combinación con otros fármacos para el tratamiento de la hepatitis C crónica no comercializados hasta la fecha. Aunque los datos son aún limitados, no se han identificado problemas relevantes de seguridad en ninguna de estas combinaciones y los resultados de eficacia parecen prometedores. Dado que estos fármacos aún no se encuentran comercializados y los datos son preliminares en la mayoría de los casos, no se hacen recomendaciones específicas sobre su uso en el presente documento
Teniendo en cuenta el beneficio observado en las tasas de curación en distintas situaciones clínicas, la buena tolerabilidad y el perfil de seguridad de las diferentes combinaciones estudiadas, sofosbuvir es un medicamento que puede presentar un valor terapéutico añadido respecto al tratamiento estándar en diversos escenarios.
Genotipo 1
No existen estudios de comparación directa entre SOF + RBV ± PEG con PEG + RBV o PEG + RBV+ IP. Metodológicamente, el diseño del estudio presenta ciertas limitaciones (principalmente ausencia de grupo control, lo que limita el control de los sesgos de selección, observación y análisis). Esto dificulta la posibilidad de llevar a cabo una comparación indirecta ajustada de los diferentes antivirales directos. Sin embargo, dado que los diferentes estudios emplearon la misma variable principal de estudio y las poblaciones son comparables, aunque no sea posible establecer una comparación estadística, si nos permiten contextualizar los resultados obtenidos en función de las tasas de respuesta obtenidas
En pacientes infectados por VHC genotipo 1 naïve y con hepatopatía compensada, el tratamiento con SOF + PEG + RBV durante 12 semanas supone una mejora respecto al tratamiento con PEG + RBV + boceprevir o telaprevir, tanto en tasas de curación (90% frente a 67─75%) como en la duración del tratamiento (12 frente a 24-48 semanas), aunque no existen estudios de comparación directa. Los porcentajes de curación en cirróticos son ligeramente inferiores respecto a los pacientes no cirróticos (81% frente a 92%) pero siguen siendo elevados; no existen estudios sobre la prolongación del tratamiento para mejorar este resultado
La biterapia SOF + RBV en pacientes con genotipo 1 no tratados previamente obtiene tasas no superiores de RVS respecto a la triple terapia con IP (68%; ensayo SPARE) en hepatopatías compensadas, normalmente prolongando el tratamiento a 24 semanas. Esta combinación debe considerarse subóptima y utilizarse únicamente en pacientes con contraindicaciones para el uso de IFN y cuando las otras combinaciones libres de interferón no estén disponibles
No existen estudios específicos de SOF + PEG + RBV en sujetos no respondedores a tratamientos previos con PEG/RBV. En los pacientes que históricamente se han asociado a una tasa de respuesta menor a los tratamientos con interferón, y en base a los datos disponibles de SOF, se recomienda prolongar la duración de tratamiento a 24 semanas en los pacientes con respuesta nula a tratamiento previo a PEG. En cualquier caso, esta afirmación requiere ser confirmada con datos específicos en esta población
No se dispone de información sobre SOF + RBV ± PEG en pacientes que hayan fracasado al tratamiento con BOC o TVR.
Genotipo 2
En los pacientes con genotipo 2 no cirróticos, la biterapia con SOF + RBV durante 12 semanas obtiene buenos resultados, tanto en naïve (97% frente a 82% con PEG + RBV durante 24 semanas), como en no respondedores a tratamiento previo con PEG + RBV (90%). En pacientes cirróticos los resultados son ligeramente inferiores (83% en naïve, 60% en no respondedores previos); en éstos, la prolongación de SOF + RBV hasta 16 semanas incrementa las tasas de respuesta viral hasta un 78%. En pacientes cirróticos que no tengan contraindicaciones al tratamiento con interferón y/o en no respondedores, podría considerarse PEG + RBV + SOF durante 12 semanas, dado que en no respondedores previos esta pauta proporciona tasas de RVS12 del 100% en no cirróticos y del 93% en cirróticos (estudio LONESTAR-2).
Genotipo 3
En pacientes naïve, los estudios demuestran que, a diferencia de lo observado en el G2, 12 semanas de SOF + RBV son insuficientes, e incluso inferiores, respecto al estándar de tratamiento en la tasa de RVS. La prolongación de SOF + RBV de 12 a 24 semanas aumenta de forma significativa la tasa de RVS excepto en pacientes no respondedores con cirrosis. No se dispone de ensayos clínicos de comparación directa de la terapia de SOF + RBV frente a PEG + RBV ambos grupos tratados durante 24 semanas
La triple terapia PEG + RBV + SOF durante 12 semanas en no respondedores previos obtuvo un 83% de RVS tanto en cirróticos como en no cirróticos (estudio LONESTAR-2)
Estas dos terapias suponen una mejoría respecto al tratamiento actual con PEG + RBV, donde la tasa global de RVS en pacientes naïve es 66%, y 55% en cirróticos
En base a todo lo anterior, las dos pautas finalmente recomendadas en ficha técnica para los pacientes con genotipo 3, fueron SOF + PEG + RBV durante 12 semanas y SOF + RBV 24 semanas. Se considera que SOF en biterapia con RBV durante 24 semanas podría considerarse sólo en pacientes naïve cirróticos con contraindicación a interferón, donde, tal y como se ha mencionado anteriormente, SOF + RBV ha mostrado una tasa de RVS del 92% (estudio VALENCE).
Genotipos 4, 5, 6
En los pacientes con genotipo 4 naïve y con hepatopatía compensada, la combinación PEG + RBV + SOF durante 12 semanas obtiene una tasa de RVS12 del 96% (27 de 28 pacientes), tasas muy superiores a la esperable con el tratamiento estándar actual PEG + RBV durante 48 semanas (aproximadamente 50%)
Los ensayos clínicos incluyeron un número limitado de pacientes y hay ausencia de ensayos controlados aleatorizados que comparen directamente la combinación PEG + RBV + SOF vs. la terapia estándar. Sin embargo, teniendo en cuenta que la actividad in vitro de sofosbuvir frente a estos genotipos es similar a la mostrada frente al genotipo 1, y considerando la consistencia de los resultados observados en los ensayos clínicos entre estos genotipos y el genotipo 1 se considera que la evidencia total en estos pacientes es suficiente para establecer recomendaciones de tratamiento similares a las de pacientes infectados por el genotipo 1
La pauta SOF + RBV ha sido evaluada en un estudio fase IIb, aleatorizado, que evalúa SOF + RBV durante 12 semanas frente a 24 semanas. El estudio incluye 60 pacientes (23% cirróticos), y en él, la RVS12 en los 28 pacientes naïve fue 79% y 100% para las 12 y 24 semanas respectivamente y de 59% y 87% respectivamente en los 32 paciente pre-tratados
En pacientes elegibles para tratamiento con IFN, la opción más recomendable sería SOF + PEG + RBV durante 12 semanas. En no elegibles a interferón, el tratamiento sería SOF + RBV durante 24 semanas
Los genotipos 5 y 6, dada su baja prevalencia, se incluyeron en los estudios en un número muy pequeño. La terapia SOF + PEG + RBV durante 12 semanas mostró tasas de RVS12 del 97%, muy superiores a las esperables con el tratamiento estándar actual (PEG + RBV durante 48 semanas). No existen datos en no respondedores previos a PEG + RBV, aunque en base a las elevadas tasas de respuesta observadas en pacientes naïve y el comportamiento de sofosbuvir en pacientes previamente tratados, podrían esperarse tasas de respuesta elevadas. Sin embargo, esto debe ser confirmado. En pacientes no elegibles para , se podría considerar la combinación de SOF + RBV durante 24 semanas.
Coinfección VIH/VHC
El uso de SOF + RBV en pacientes VIH/VHC no parece presentar peculiaridades en eficacia y seguridad, obteniéndose resultados similares a los pacientes monoinfectados en los estudios específicos realizados. Las tasas de RVS obtenidas con esta combinación son muy superiores a las que se consiguen con PEG + RBV en el momento actual. Por este motivo, muy probablemente podamos esperar tasas de erradicación del VHC similares en los subgrupos de pacientes no específicamente estudiados
SOF carece de interacciones significativas con antirretrovirales, aunque se desaconseja su uso con tipranavir/ritonavir
Por todo ello, tanto la indicación como las estrategias de tratamiento en pacientes coinfectados por VIH/VHC deberían ser idénticas a las de los pacientes monoinfectados. Todo lo referido previamente para cada genotipo en los pacientes monoinfectados aplicaría igual en los pacientes coinfectados VIH/VHC.
Pacientes en lista de espera de trasplante hepático
La experiencia con SOF en el trasplante hepático por infección crónica por el VHC es escasa. Aunque los resultados preliminares son prometedores, son necesarios más estudios para establecer la mejor pauta de tratamiento en estos pacientes. Sin embargo, en esta situación clínica sofosbuvir se presenta como la única alternativa terapéutica y debido a la importancia de los resultados observados, éstos no pueden ser omitidos
Los pacientes en lista de espera de trasplante hepático no se encuentran obligatoriamente descompensados, pero generalmente presentan una enfermedad hepática avanzada con criterios de riesgo para descompensación, por lo que deben priorizarse regímenes de tratamiento libres de interferón
Los resultados preliminares en pacientes en lista de espera de trasplante hepático con carcinoma hepatocelular y cirrosis compensada son esperanzadores. Sin embargo, hay que tener en cuenta que se tratan de pocos pacientes evaluados y que no tiene grupo comparador. Es extremadamente importante que los pacientes sean trasplantados con el virus indetectable desde, al menos, un mes antes del trasplante, lo que en teoría no debería ser difícil de conseguir, ya que el período en lista de espera es, normalmente, de varios meses
Por lo tanto, debe elegirse siempre como primera opción de tratamiento aquella que implique la mayor posibilidad de RVS y menor duración, atendiendo a las características de la enfermedad del paciente. Dentro de la lista de espera, hay pacientes con descompensación hepática y sin ella. Ambos deberían recibir una terapia basada en SOF. En pacientes compensados (Child-Pugh A), no están contraindicados los regímenes con interferón. Si no presentan contraindicaciones al uso de PEG, SOF + PEG + RBV es una alternativa de tratamiento. Los pacientes prioritarios para tratamiento con SOF + RBV serían aquellos pacientes más graves o con descompensación (Child-Pugh B o C)
SOF + RBV hasta el trasplante es una opción adecuada. La duración óptima del tratamiento no está claramente definida, pero es recomendable como mínimo 12 semanas. SOF+ PEG+RBV durante 24 semanas sólo debe considerarse si la función hepática está preservada
En los pacientes en lista de espera de trasplante hepático por hepatopatía C descompensada están contraindicados los regímenes que contengan interferón y, por otro lado, son válidas las mismas consideraciones que en el punto anterior en cuanto a la necesidad de que el virus esté indetectable al menos 1 mes antes del trasplante
En ambos grupos, compensados o no pero especialmente en el primer grupo que es de donde se tienen más datos, la probabilidad de RVS parece muy dependiente del tiempo que el virus permanece indetectable antes del trasplante hepático (69% si >1 mes, 4% si <1 mes) por lo que se debe recomendar un inicio lo más precoz posible del tratamiento antiviral, tan pronto como el paciente es incluido en lista de espera de TH.
Pacientes trasplantados con reinfección de hepatitis C
En pacientes ya trasplantados con hepatitis C recurrente, SOF + RBV durante 24 semanas logra una tasa de RVS12 del 70%, con muy buena tolerabilidad. A la espera de resultados definitivos, éstos parecen superiores a los obtenidos con PEG + RBV ± BOC/TVR, especialmente en lo relativo a tolerabilidad, interacciones farmacológicas y efectos secundarios
Según los resultados del Programa de uso compasivo, en pacientes con reinfección grave del injerto y/o hepatitis colestásica fibrosante se ha utilizado SOF + RBV (con o sin interferón pegilado) hasta 48 semanas con una tasa de RVS del 60%. Es importante destacar que en una proporción considerable de casos se produce mejoría clínica (como disminución de las descompensaciones)
Otras opciones de tratamiento en pacientes trasplantados incluyen combinaciones de sofosbuvir con otros antivirales directos, con o sin ribavirina. Aunque datos preliminares muestran resultados prometedores, dichas combinaciones no forman parte del objetivo del presente informe.
Pacientes con enfermedad hepática avanzada:
Los pacientes con fibrosis significativa son particularmente importantes y deben ser identificados previo al inicio del tratamiento, dado que su pronóstico está alterado y su tratamiento debe ser adaptado. En los pacientes con fibrosis F3-F4 y enfermedad hepática compensada, el tratamiento está indicado para prevenir las complicaciones a corto y largo plazo y, por tanto, debe priorizarse a estos pacientes. Son preferibles regímenes libres de interferón a menos que la función hepática esté preservada y no tengan citopenias, en cuyo caso, podrían ser válidos regímenes con IFN bajo estrecha monitorización. En estos pacientes, las tasas de respuesta con BOC o TVR + PEG/RBV son significativamente más bajas que en los esquemas que utilizan sofosbuvir (42% BOC + PR, 54% TVR + PR en naïve vs. 80% SOF + PR en naïve) Como se mencionó previamente, en pacientes con enfermedad hepática descompensada el uso de IFN está contraindicado y, por tanto, sólo deben usarse regímenes libres de IFN.
CONCLUSIÓN
A pesar de las limitaciones de los estudios descritas anteriormente, se considera que sofosbuvir presenta valor terapéutico añadido en comparación con los estándares actuales de tratamiento de la infección crónica por el virus de la hepatitis C en determinados escenarios clínicos y para las distintas pautas de tratamiento estudiadas. Sofosbuvir presenta tasas elevadas de RVS12, un buen perfil de seguridad, menor duración de tratamiento y la posibilidad de ser usado sin PEG en determinados grupos de pacientes
En consonancia con las consideraciones anteriores, se establecen las siguientes conclusiones, válidas para pacientes monoinfectados y coinfectados y que de igual modo aplican a G1-6, en base a la necesidad de tratamiento, existencia de alternativas terapéuticas y, en su caso, valor terapéutico añadido respecto de las mismas:
A) Situaciones clínicas en las que existe necesidad de tratamiento debido al avanzado estado de la enfermedad y/o alto riesgo de morbi-mortalidad asociada y no existen alternativas terapéuticas o bien las existentes no son adecuadas debido a problemas de seguridad
Lista de espera de trasplante hepático
Todos los pacientes en lista de espera de trasplante hepático deben recibir tratamiento antiviral tan pronto como se incluyan en lista activa de trasplante con el objetivo de evitar la reinfección del injerto y sus consecuencias negativas sobre la supervivencia del paciente y del injerto. En estos pacientes está contraindicado el tratamiento basado en IFN, excepto en pacientes con función hepática preservada y sin citopenias significativas. Si se plantea un tratamiento con IFN en pacientes concretos, existen distintas alternativas terapéuticas. Podría valorarse usar PEG/RBV en combinación con un IP o bien PEG + RBV + sofosbuvir
Las combinaciones sin interferón basadas en sofosbuvir tienen valor terapéutico añadido en base a reducción de la reinfección del injerto observada y la buena tolerabilidad del tratamiento. En base a los datos disponibles, es recomendable el tratamiento de SOF + RBV hasta el momento del trasplante hepático con una duración mínima del tratamiento de 12 semanas.
Trasplantados hepáticos
Los tratamientos basados en interferón, particularmente en combinación con un IP, tienen en estos pacientes un perfil de seguridad difícilmente aceptable, existiendo muchos pacientes con contraindicaciones absolutas al tratamiento. Se debe valorar individualmente la posibilidad de administrar o no un régimen que lo contenga
Sofosbuvir en combinación con ribavirina en pacientes con reinfección grave (durante un máximo de 48 semanas) y no grave (durante 24 semanas) del injerto ha demostrado buena tasa de RVS y buena tolerabilidad, con lo que se considera que tiene valor terapéutico añadido, en pacientes que no sean candidatos a IFN. Estos pacientes tienen clara indicación de tratamiento antiviral debido al alto riesgo de morbi-mortalidad asociada a la reinfección.
Cirróticos (F4 en biopsia o Fibroscan ≥ 14,5 kPa, coinfectados
14kPa*):
Debido al avanzado estado de la enfermedad y el alto riesgo de complicaciones hepáticas, existe necesidad de tratamiento indiscutible y prioritaria. La tolerabilidad y seguridad del tratamiento basado en IFN es mala en estos pacientes (mortalidad cercana al 1% y eventos adversos graves >50%) y de hecho su uso está contraindicado en pacientes con cirrosis descompensada (EASL 2014). A pesar de los pocos datos disponibles, SOF + RBV (24-48 semanas) es una alternativa con valor terapéutico añadido en base a las tasas de curación y al perfil de seguridad
* En caso de ausencia de biopsia o fibroscan se considerarán factores como la presencia de varices esofágicas, ascitis y la posibilidad de diagnóstico por TAC o RMN
Pacientes con contraindicaciones para tratamiento basado en IFN
o tras fracaso al tratamiento con inhibidores de la proteasa
A pesar de la ausencia de datos del uso de sofosbuvir en pacientes que han fracasado al tratamiento con IP, en la actualidad, estos pacientes no tienen otra alternativa terapéutica. Por tanto, cualquier paciente con hepatitis C crónica, independientemente del grado de fibrosis hepática, que presente contraindicaciones para tratamiento basado en IFN o que haya fracasado al tratamiento con IP y con indicación de tratamiento activo en base a criterios clínicos, es candidato a recibir tratamiento con sofosbuvir. En estos pacientes, los medicamentos recomendados para administración concomitante y la duración del tratamiento para la terapia combinada son aquellos recomendados en ficha técnica (ver tabla 1)
Nota: las duraciones de tratamiento de más de 24 semanas se basan fundamentalmente en la experiencia clínica y en los datos del uso compasivo
B) Situaciones clínicas en las que existiendo necesidad de tratamiento y alternativas terapéuticas, sofosbuvir se considera una opción con valor terapéutico añadido en base a eficacia y/o seguridad.
Se presentan en base al grado de necesidad médica de tratamiento y el valor terapéutico añadido respecto de las alternativas terapéuticas, cuando éstas existen. Los medicamentos recomendados para administración concomitante y la duración del tratamiento para la terapia combinada son aquellos recomendados en ficha técnica (ver tabla 1)
Cabe mencionar que este grupo es el más numeroso en términos absolutos y, por otro lado, existen alternativas terapéuticas.
Pacientes con F3 en biopsia ó Fibroscan >9,5 Kpa.
Este grupo podría ser candidato al tratamiento con biterapia o con triple terapia con un IP, según genotipo y dependiendo de las características individuales de cada paciente, si bien la terapia basada en sofosbuvir tiene valor terapéutico añadido en base a tasas de respuesta y fundamentalmente mejor tolerabilidad/seguridad
En casos determinados, el tratamiento estándar podría no ser considerado una opción aceptable y, por tanto, serían aplicables las consideraciones del apartado A.
Pacientes con F2 en biopsia ó Fibroscan 7,6- 9,5 Kpa.
En el caso de genotipos 2 y 3, estos pacientes podrían ser candidatos a tratamiento con biterapia PEG + RBV. Los pacientes con genotipo 1 y 4, podrían además ser candidatos a triple terapia basada en IP
Sofosbuvir tiene valor terapéutico añadido en base a la mayor tasa de respuesta viral sostenida (y a la mejor tolerabilidad/perfil de seguridad, debida al acortamiento del tratamiento a 12 semanas)
REFERENCIAS
1. Guidelines for the screening, care and treatment of persons with hepatitis infection. WHO April 2014. Disponible en: http://apps.who.int/iris/bitstream/10665/111747/1/9789241548755_e ng.pdf?ua=1&ua=1 2. EASL Recommendations on Treatment of Hepatitis C 2014. Disponible en: http://files.easl.eu/easl-recommendations-on- treatment-of-hepatitis-C/index.html 3. Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes co- infectados por el VIH y trasplantados hepáticos. Disponible en: http://www.aemps.gob.es/medicamentosUsoHumano/informesPublic os/docs/IPT-criterios-VHC-co-infectados.pdf 4. Berenguer J, Álvarez-Pellicer J, Martin PM, et al. Sustained virological response to interferon plus ribavirin reduces liver-related complications and mortality in patients coinfected with human immunodeficiency virus and hepatitis C virus. Hepatology
2009;50(2):407-413
5. Charlton MR, Gane E, Manns M, et al. Sofosbuvir and Ribavirin for the Treatment of Established Recurrent Hepatitis C Infection After Liver Transplantation: Preliminary Results of a Prospective, Multicenter Study. Hepatology: Special Issue: The 64th Annual Meeting of the American Association for the Study of Liver Diseases: The Liver Meeting 2013. 2013;Vol 58(4):1378A
6. Coilly A, Roche B, Dumortier J, et al. Safety and efficacy of protease inhibitors to treat hepatitis C after liver transplantation: A multicenter experience. J.Hepatol. 2014;60(1):78-86
7. Crippin JS, McCashland T, Terrault N, Sheiner P, Charlton MR. A pilot study of the tolerability and efficacy of antiviral therapy in hepatitis C virus-infected patients awaiting liver transplantation. Liver Transpl. 2002;8(4):350-355
8. Curry MP, et al. Pretransplant Sofosbuvir and Ribavirin to Prevent Recurrence of HCV Infection after Liver Transplantation
64th Annual Meeting of the American Association for the Study of Liver Disease. Nov 1-5, 2013, 2013; Washington, DC
9. Di Bisceglie A, Kuo A, Rustgi V, Sulkowski M. Virological Outcomes and Adherence to Treatment Algorithms in a Longitudinal Study of Patients with Chronic Hepatitis C Treated with Boceprevir or Telaprevir in the U.S. (HCV-TARGET). AASLD The Liver Meeting. Nov 1-5, 2013, 2013; Washington, DC; 2013
10. Ficha Técnica de Sofosbuvir disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_- _Product_Information/human/002798/WC500160597.pdf 11. EPAR de Sofosbuvir disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_- _Public_assessment_report/human/002798/WC500160600.pdf 12. Forns X, Fontana RJ, Moonka D, et al. Initial Evaluation of the Sofosbuvir Compassionate Use Program for Patients with Severe Recurrent HCV Following Liver Transplantation. Special Issue: The 64th Annual Meeting of the American Association for the Study of Liver Diseases: The Liver Meeting 2013. Epub Oct 1, 2013, 10-1- 2013a;732A.
GRUPO DE EXPERTOS
(por orden alfabético)
Agencia Española de Medicamentos y Productos Sanitarios
Centro de Información Farmacoterapéutica del Servizo Galego de Saúde
Comité de Evaluación de Nuevos Medicamentos en el Ámbito
Hospitalario de Euskadi
Grupo Técnico de Utilidad de Medicamentos Hospitalarios de la
Comunidad de Madrid
Programa de Armonización Farmacoterapéutica del Servicio
Catalán de la Salud
Los miembros del Consejo asesor y de la Comisión farmacoterapéutica en el ámbito hospitalario pueden consultarse en la página web www.gencat.cat/catsalut
Arantxa Sancho López
Servicio de Farmacología Clínica. Hospital Universitario Puerta de Hierro Majadahonda, Madrid. Miembro del Comité de Medicamentos de Uso Humano (CHMP) de la EMA.
Grupo de Expertos en Hepatitis C:
Rafael Bañares Cañizares
Servicio de Aparato Digestivo (Sección de Hepatología). Hospital General Universitario Gregorio Marañon, Madrid
Juan Berenguer Berenguer
Unidad de Enfermedades Infecciosas/VIH. Hospital General Universitario Gregorio Marañón de Madrid
José Luis Calleja Panero
Servicio de Gastroenterología (Unidad de Hepatología). Hospital Universitario Puerta de Hierro Majadahonda
Rafael Esteban Mur
Servicio de Hepatología. Hospital Vall d'Hebron, Barcelona
Xavier Forns Bernhardt
Servicio de Hepatología. Hospital Clinic de Barcelona, Ciberehd, IDIBAPS
Juan González García
Servicio de Medicina Interna (Unidad de VIH). Hospital Universitario La Paz de Madrid
María Luisa Montes Ramírez
Servicio de Medicina Interna (Unidad VIH). Hospital Universitario La Paz, Madrid
Antonio Olveira Martín
Servicio de Aparato Digestivo (Unidad de Hepatología). Hospital Universitario La Paz, Madrid
Martín Prieto Castillo
Unidad de Hepatología. Servicio de Medicina Digestiva. Hospital Universitario y Politécnico La Fe, Valencia
Manuel Romero Gómez
Unidad de Gestión Médico-Quirúrgica de Enfermedades Digestivas y ciberehd. Hospital Universitario de Valme. Universidad de Sevilla
Belén Ruiz Antorán
Servicio de Farmacología Clínica. Hospital Universitario Puerta de Hierro Majadahonda
Maria Jesús Téllez Molina
Servicio de Medicina Interna (Unidad de VIH). Hospital Clínico San Carlos de Madrid
Miguel Angel von Wichmann de Miguel
Unidad de Enfermedades Infecciosas. Hospital Donostia (San Sebastián) Todos los expertos han realizado una declaración de conflictos de interés
El Laboratorio Titular, la Sociedad Española de Trasplante Hepático, la Asociación Española para el Estudio del Hígado, la Federación Nacional de Enfermos y Trasplantados Hepáticos y la Federación Española de Hemofilia han tenido oportunidad de enviar comentarios al documento, si bien el texto final es el adoptado por el GCPT.
Fe de erratas
Con fecha 20 de noviembre de 2014, se han corregido las siguientes erratas: • En la Conclusión, apartado B, donde decía “En casos determinados, el tratamiento estándar podría no ser considerado una opción aceptable y, por tanto, serían aplicables las consideraciones del apartado A.- Pacientes con F2 en biopsia ó Fibroscan 7,6- 9,5 Kpa.”, debe decir: “En casos determinados, el tratamiento estándar podría no ser considerado una opción aceptable y, por tanto, serían aplicables las consideraciones del apartado A.
Pacientes con F2 en biopsia ó Fibroscan 7,6- 9,5 Kpa.”
• En las Referencias, la tercera referencia, donde decía: Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes infectados por el VIH, en trasplantados de hígado y en población pediátrica. Disponible en: http://www.aemps.gob.es/medicamentosUsoHumano/medSitua cionesEspeciales/docs/criterios-VHC-off-label.pdf, debe decir: Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir de la hepatitis crónica C en pacientes co- infectados por el VIH y trasplantados hepáticos. Disponible en: http://www.aemps.gob.es/medicamentosUsoHumano/informesP ublicos/docs/IPT-criterios-VHC-co-infectados.pdf




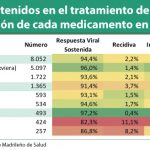















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 