La Sociedad Española de Farmacia Hospitalaria (SEFH) ha alcanzado un consenso con la Sociedad Española de Oftalmología (SEO) sobre recomendaciones de utilización y elaboración de preparaciones oftálmicas en medicamentos “cuyas indicaciones oftalmológicas no están autorizadas ni disponibles comercialmente en una forma adecuada para esta vía de administración”.
De este modo, el consenso, que ha sido publicado en la revista Farmacia Hospitalaria, aborda una serie de recomendaciones y pautas para establecer “criterios de calidad que aseguren su efectividad, estabilidad y esterilidad”. Además, el consenso aborda “recomendaciones para su utilización de acuerdo con la legislación vigente” y, con el “ánimo de armonizar la preparación de inyecciones intraoculares en los Servicios de Farmacia Hospitalaria, se establecen unas recomendaciones generales para su elaboración siguiendo los estándares establecidos en la Guía de Buenas Prácticas de Preparación de Medicamentos en los Servicios de Farmacia Hospitalaria”.
El consenso realiza un repaso de los requisitos legales que existen para la utilización de medicamentos en condiciones distintas a las descritas en ficha técnica, que están reguladas por el Real Decreto 1015/2009, donde se las define como “Uso de medicamentos en condiciones diferentes de las autorizadas” (UMCDA).
La SEFH y la SEO han elaborado un protocolo para la utilización de estos medicamentos fuera de indicación en el que se recogen aspectos como el objetivo, las responsabilidades, el desarrollo del procedimiento en cuanto a diagnóstico, establecimiento de tratamiento, prescripción y dispensación, entre otras cuestiones.
El documento incluye una tabla que aborda los tratamientos preparados como colirios y otra para preparaciones intraoculartes. Para la primera de ellas destacan preparaciones de acetilcisteína, amikacina, bevacizumab, ciclosporina, interferón alfa 2B-1, vancomicina o voriconazol. En cuanto a las preparaciones intraoculares, se describen tratamientos con bevacizumab, ceftazidima, mitomicina, fenilefrina, vancomicina o voriconazol. En todos ellos se establecen las indicaciones UMCDA para los que se podrían utilizar, así como la posología habitual y en el caso de preparaciones intraoculares, la vía de administración.
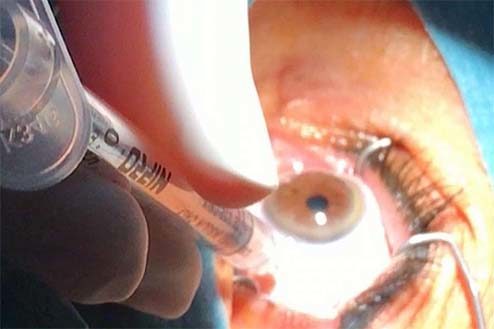
El consenso también recoge un anexo con recomendaciones para la elaboración de las preparaciones intraoculares, que deben ser efectuadas “en cabina de flujo laminar (CFL) horizontal o vertical (según valoración del riesgo de peligrosidad del medicamento) con entorno controlado”.
Según se recoge en las conclusiones del documento, “existe una amplia evidencia clínica que avala la utilización de los medicamentos seleccionados en este trabajo para su uso oftálmico, aunque tal uso no esté reconocido para todos ellos por las autoridades sanitarias”. Además, consideran que legalmente, estas preparaciones se encuadrarían en lo que se denomina utilización de medicamentos en condiciones diferentes a las autorizadas y su uso “debería incorporase a los protocolos asistenciales consensuados con los Servicios de Oftalmología y aprobados por la Comisión de Farmacia y Terapéutica y por la Dirección del centro”. Por otro lado, los firmantes explican que “existe también evidencia galénica que permite la preparación de esos medicamentos de forma que puedan ser administrados por vía oftálmica, en forma de colirios o en forma de inyecciones intraoculares”.
Además, SEFH y SEO coinciden al valorar que “las recomendaciones específicas sobre la preparación de intraoculares establecidas en este documento ayudarán a armonizar y facilitarán la preparación de estos medicamentos en los servicios de Farmacia Hospitalaria contribuyendo a la equidad en el acceso de todos los pacientes a este tipo de preparaciones”.
Por último, cabe recordar que algunas de las preparaciones incluidas en este consenso han sido muy polémicas a lo largo de los últimos años por utilizarse medicamentos sin la indicación aprobada en procesos que sí disponían de medicamentos autorizados al efecto. Es el caso, por ejemplo del uso de bevacizumab en DMAE.










 Lilisbeth Perestelo:
Lilisbeth Perestelo:  César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Un comentario
Un concepto muy interesante.
saludos
SEO Murcia
https://www.everiti.com