La Agencia Europea del Medicamento (EMA) ha anunciado hoy que el Comité de Medicamentos de Uso Humano (CHMP) de dicho organismo ha iniciado el proceso de evaluación continua de Vidprevtyn, la vacuna frente al covid-19 desarrollada por Sanofi Pasteur.
Según explica este organismo en un comunicado el Comité ha valorado tanto los primeros estudios clínicos, como los resultados preliminares en laboratorio, que sugieren “que la vacuna desencadena la producción de anticuerpos dirigidos contra el SARS-CoV2 y puede ayudar a proteger contra la enfermedad”.
La EMA realizará la evaluación hasta que disponga de suficientes pruebas para recomendar la solicitud formal de autorización de comercialización. El regulador europeo no ha manifestado ningún tipo de plazo para emitir su veredicto sobre la vacuna, aunque indica que su parecer deberá tardar “menos de lo normal”.
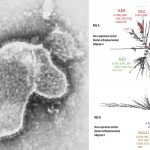
Vidprevtyn es una vacuna basada en proteínas que contiene una versión cultivada en laboratorio de la proteína spike (S) que se encuentra en la superficie del SARS CoV-2. También contiene como adyuvante una sustancia que ayuda a reforzar la respuesta inmunitaria a la vacuna.
El mecanismo de defensa consiste en que el sistema inmunitario de la persona que recibe la vacuna identifica la proteína S como extraña y produce anticuerpos contra ella. Si la persona entra posteriormente en contacto con el coronavirus, el sistema inmunitario lo reconocerá y estará preparado para defender el organismo.
El proceso de evaluación de esta vacuna seguirá el cauce normal, mientras el CHMP recibe información y revista datos. En el momento que considere que cuenta con información suficiente, la empresa podrá presentar la solicitud de autorización de comercialización de uso urgente, la cual, en el caso de las vacunas frente al covid-19 suele tener un efecto casi inmediato.
El pasado mes de diciembre, el pasado proyecto de la vacuna del laboratorio francés, en colaboración con el británico GSK, demostró ser ineficaz en la protección frente al SARS-CoV-2 en los ensayos con humanos. Sanofi y GSK anunciaron que retrasaban el desarrollo de su suero; si bien aseguraban poder contar con un producto a a finales del primer semestre de 2021, las empresas lo retrasaron hasta finales del año.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 