GSK y Vir Biotechnology han anunciado que el Comité de Medicamentos para Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA) ha emitido una opinión científica positiva de sotrovimab. El dictamen se refiere al uso de este medicamento para el tratamiento de pacientes adultos y adolescentes (de 12 años o más y con un peso mínimo de 40 kg) con covid-19 leve o moderada con alto riesgo de progresión a hospitalización o muerte.
Christopher Corsico, Senior Vice President, Development de GSK, ha afirmado que, “a medida que continúa la pandemia de covid-19 y el virus genera nuevas variantes preocupantes, incluidas las que surgieron recientemente en India, la necesidad de tratamientos que puedan retardar la progresión de la enfermedad en los pacientes que tienen un alto riesgo de desarrollar complicaciones graves sigue siendo una prioridad máxima”. Los tratamientos con anticuerpos monoclonales son “una parte fundamental de una solución integral para la covid-19, especialmente porque menos del 40% de los adultos en los estados miembros de la UE han recibido al menos una dosis de una vacuna hasta la fecha”. “Nos alienta esta opinión científica positiva de la EMA, ya que esperamos que nos acerque más a hacer que sotrovimab esté disponible para los pacientes de toda Europa”, ha asegurado.
Por su parte, George Scangos, Ph.D., chief executive officer de Vir, ha comentado lo siguiente: “La opinión de hoy es una gran noticia para los pacientes de toda Europa, ya que los estados miembros de la UE ahora pueden avanzar más fácilmente con sus propias autorizaciones temporales para sotrovimab. Según nuestros datos in vitro más recientes, sotrovimab continúa combatiendo la covid-19 a medida que evoluciona y ha mantenido la actividad frente a todas las variantes circulantes de interés. Esperamos seguir trabajando con los reguladores de todo el mundo para que sotrovimab esté disponible para más pacientes que lo necesiten y ayudar a poner fin a la pandemia".
El CHMP ha emitido su opinión tras una revisión de datos que incluía un análisis intermedio de eficacia y seguridad de los datos del estudio de fase III COMET-ICE COVID-19 Monoclonal antibody Efficacy Trial - Intent to Care Early), que evaluó sotrovimab como monoterapia para el tratamiento en fases tempranas de la covid-19 en adultos con alto riesgo de hospitalización. Los resultados del análisis intermedio, basados en datos de 583 pacientes que han participado en el ensayo, han demostrado una reducción del 85% (p = 0,002) en la hospitalización o muerte en pacientes que recibieron sotrovimab como monoterapia en comparación con placebo, el criterio de valoración principal del ensayo. Como resultado de estos datos, un Comité Independiente de Monitorización de Datos (IDMC por sus siglas en inglés) recomendó que el ensayo detuviera la incorporación de más pacientes debido a la evidencia de una gran eficacia. La revisión del CHMP también consideró datos sobre la calidad y seguridad del medicamento.
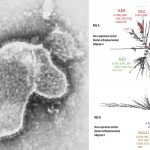
El CHMP también estudió los datos de varios estudios in vitro que demostraron que sotrovimab mantiene la actividad frente a múltiples variantes circulantes de especial interés, incluidas las de Brasil (P.1), California (B.1.427 / B.1.429), Sudáfrica (B. 1.351) y Reino Unido (B.1.1.7), basado en datos de ensayos in vitro con virus vivos y virus pseudotipados. BioRxiv también publicó recientemente datos in vitro adicionales que demuestran actividad frente a las variantes de Nueva York (B.1.526) e India (B.1.617). Aún no se conoce el impacto clínico de estas variantes. Sotrovimab se une a un epítopo altamente conservado de la proteína spyke del SARS-CoV-2 que es menos probable que mute con el tiempo. La recopilación y el análisis de datos aún están en curso.
La revisión del CHMP ha tenido lugar en paralelo al proceso de rolling review de la EMA, que se utiliza para acelerar la evaluación formal de la solicitud de comercialización de un medicamento prometedor durante una emergencia de salud pública. Este proceso continuará hasta que haya suficientes datos disponibles para respaldar una Solicitud de Autorización de Comercialización formal.
Se ha enviado una solicitud de Autorización de Uso de Emergencia (EUA, por sus siglas en inglés) para sotrovimab a la FDA de Estados Unidos y también está siendo revisada por otros reguladores a nivel mundial, incluido Health Canada, bajo la vía de solicitud de orden provisional acelerada para medicamentos frente a la covid-19.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: