Hace unos días el Tribunal Supremo dictó una sentencia, que crea jurisprudencia, en relación con el cálculo del precio de referencia en función de las dosis diarias definidas (DDD). En concreto, el Alto Tribunal consideraba que, en caso de que se tratara de medicamentos no equipotentes, sería necesario calcular una DDD propia para realizar el cálculo del precio en función del efecto logrado y no de la cantidad de principio activo.
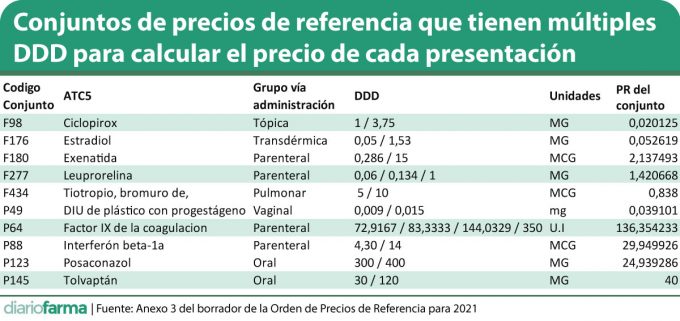
Diariofarma ha podido constatar que actualmente hay al menos 10 conjuntos en los que el Ministerio de Sanidad ha reconocido la existencia de diferentes DDD para el cálculo del precio de referencia.
En esta situación encontramos, de acuerdo con anexo 3 del borrador de la Orden de Precios de Referencia para 2021, los siguientes conjuntos: F98 (ciclopirox); F176 (estradiol); F180 (exenatida); F277 (leuprorelina); F434 (bromuro de tiotropio); P49 (DIU de plástico con progestágeno); P64 (factor IX de la coagulación); P88 (interferón beta-1a); P123 (posaconazol); P145 (tolvaptán).
La característica más relevante en todos estos casos es que una nueva formulación galénica o un dispositivo más evolucionado es capaz de ofrecer con menos dosis de principio activo la misma actividad terapéutica. La ventaja adicional es que al haber menos dosis la probabilidad de efectos adversos se reduce de manera considerable. En estos casos, al tomar en consideración la eficacia de cada presentación en lugar de la cantidad de principio activo, se reconoce la innovación otorgando un precio igual al que tienen otras presentaciones incorporadas al mismo conjunto de precios de referencia, en lugar de penalizar dicha innovación mediante una reducción del precio.
La sentencia del TS del pasado 27 de octubre, reconoció esta misma situación al medicamento Envarsus, de Chiesi, incorporado al conjunto C226 de tacrolimus en la OPR de 2016. Eso sí, en el último borrador de la OPR, el conjunto F417 correspondiente a tacrolimus no incorpora la doble DDD y, por tanto, no se habría reconocido de oficio por parte del Ministerio de Sanidad la idoneidad de ese diferente cálculo que ahora el Tribunal Supremo ha sentenciado. Habrá que esperar a la publicación de la Orden de Precios de Referencia en el Boletín Oficial del Estado (BOE), algo que podría ser inminente, para confirmar el cambio.
Otros casos actuales
En situación parecida estaría la especialidad Seffalair Spiromax, comercializado por Teva desde hace unos pocos meses y al que le correspondería integrarse en el conjunto F405 (salmeterol/fluticasona) de la próxima OPR. Este medicamento, debido a su formulación y dispositivo de inhalación innovador, es capaz de producir el mismo efecto con menor dosis que el resto de presentaciones incluidas en su conjunto.
Actualmente la OPR contempla un caso muy similar al de esta formulación de Teva. Se trata del conjunto F434 de bromuro de tiotropio que tiene como DDD tanto 5 como 10 mg. De este modo, las cinco presentaciones incluidas en el conjunto, dado que contienen tratamiento suficiente para 30 dosis, tienen el mismo precio (25,14 euros a PVL), pese a que la cantidad de principio activo en cada envase oscila entre 540 y 150 mcg.
Desde Diariofarma hemos querido conocer cómo valora Teva esta sentencia y cómo creen que puede influir en la situación de su medicamento. Según Rafael Borràs, director de Relaciones Institucionales y Comunicación de Teva, su caso “es más claro, dado que lo que dice la norma es que la DDD debe calcularse conforme a los criterios seguidos por la OMS”. Cabe señalar que este organismo fija las DDD teniendo en cuenta la eficacia de cada presentación y no simplemente la cantidad de principio activo. Por ese motivo, según Borràs, Seffalair Spiromax, “al ser equivalente en eficacia a otras presentaciones con mayor cantidad de principio activo, no debe tener la misma DDD que esas presentaciones, tal y como se recoge en el Real Decreto de precios de referencia”. Por ese motivo, desde Teva consideran que la interpretación de la norma que hace el TS en su sentencia coincide con la que ellos plantean. “En nuestro caso la innovación en la formulación galénica así como en el dispositivo inhalador consiguen el mismo efecto que otros medicamentos del conjunto de referencia con menor dosis”, explica Borràs.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: