Según explican los autores de un nuevo análisis publicado en Nature, los plazos de revisión de dosieres de aprobación varían considerablemente según las autoridades a las que se presenten. Así, en el periodo observado (2015 y 2016) se han registrado aprobaciones por parte de la agencia europea (EMA) en solo 210 días y demoras de hasta 900 días en el caso de la CFDA de China. Sobre esta última, se aprecia que se están realizando modificaciones para acelerar la revisión y aprobación de nuevos fármacos en este mercado, incluyendo la incorporación de más personal a los equipos técnicos.
También la agencia estadounidense del medicamento (FDA) está en proceso de mejorar la agilidad en su funcionamiento, particularmente cuando se trate de productos que responden a necesidades médicas desatendidas. Uno de los nuevos procedimientos sería la designación de revisión prioritaria, que conlleva un plazo de revisión de 180 días, frente al estándar de 300.
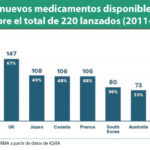
Promedios
Japón (PMDA) goza del plazo medio de aceleración más corto: en 2015 esa media fue de 311 días, por delante de la estadounidense FDA (333 días), la agencia rusa Roszdravnadzor es la siguiente, con 335 días, y le sigue Health Canadá, con 361 días de media.
En Australia transcurren un promedio de 373 días hasta la aprobación de un medicamento por parte de la agencia TGA desde la presentación del dosier. La EMA ofrece un balance de 422 días. En último lugar están la suiza Swissmedic, con 464 días y la china CFDA, con 639.
En cuanto a los pagos necesarios para la autorización, también varían enormemente: desde las 50.000 rupias indias (unos 1.000 dólares) hasta un máximo de 2,3 millones de dólares en la agencia estadounidense.
Tiempos de cambio
En general, según los autores, los reguladores de países desarrollados como Estados Unidos, miembros de la Unión Europea, Reino Unido, Canadá y Japón, están más “evolucionados” en términos de sistemas regulatorios y recursos tales como la dotación de personal técnico para las revisiones, pero tienen cuotas mucho más elevadas.
Además, indican que los marcos regulatorios de todo el mundo están experimentando cambios rápidamente, y por eso subrayan la importancia de comprender las similitudes y diferencias en cuanto a requisitos que pueden contribuir a la aceleración del proceso de revisión y aprobación de nuevos medicamentos.
Solicitudes y aprobaciones
A pesar de reconocer que la comparación de aprobaciones de nuevos medicamentos en términos numéricos es difícil, ya que cada agencia cuenta con sus propias definiciones, los autores aventuraron la presentación de solicitudes y aprobaciones entre 2015 y 2016.
La EMA recibió 61 solicitudes en 2015 y 68 en 2016, que generaron 39 autorizaciones el primer año y 27 en el segundo. En la FDA se recibieron 35 solicitudes en 2015 y 41 en 2016; el número de aprobaciones se redujo de 45 el primer año a tan solo 22 en 2016.
La PMDA japonesa fue la que aprobó más medicamentos en 2016 (48), comparados con 42 el año anterior. En 2015 el número de solicitudes en dicha agencia fue particularmente elevado: 124.
Aunque no se dispone de cifras de presentación de solicitudes en la CFDA (China), los autores sí constataron que el número de aprobaciones de nuevos fármacos, excluyendo terapias propias de la medicina tradicional del país, fue de 72 en 2015 y de 31 en 2016.




















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 