Un nuevo estudio de la consultora NDA analiza las aprobaciones de fármacos de la agencia estadounidense (FDA) y europea (EMA) en 2016 y apunta a notables disparidades entre ambas, incluida una tendencia al descenso en las autorizaciones de la FDA que no se aprecia en territorio europeo. Menos del 50% de los medicamentos aprobados ese año lo fueron en ambos territorios.
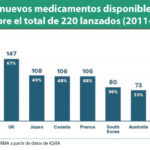
En 2016 se concedieron 74 nuevas autorizaciones, de las cuales 19 se produjeron únicamente en la Unión Europea y 39 recibieron el visto bueno de ambas agencias. Por otro lado 17 de los fármacos aprobados por la EMA en 2016 estaban disponibles desde 2015 –e incluso antes- en Estados Unidos, mientras que solo 6 fármacos aprobados por la FDA contaban previamente con la autorización de la EMA.
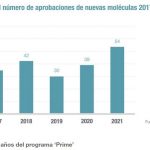
En el análisis combinado se observó que, de las aprobaciones de nuevos medicamentos, 35 encajaban en la categoría de nuevos fármacos (NAS –nueva sustancia activa-, NME –nueva entidad molecular- o BLA –licencia para producto biológico-), con 9 en la EMA, 9 en la FDA y 17 en ambas. Para la EMA, esta cifra es la menor desde 2011. La FDA no autorizaba un número tan reducido de nuevos medicamentos desde 2010.
El número de aprobaciones en la FDA muestra un descenso significativo en 2016 respecto al año anterior, aunque las revisiones y aprobaciones tienen un ritmo más ágil que el de la agencia europea, de acuerdo con los expertos de NDA.
Procedimientos excepcionales convertidos en norma
Terese Johansson, miembro del comité de expertos que ha elaborado el estudio, considera que estos hallazgos muestran que la FDA, a pesar de haber bajado el ritmo de aprobaciones, sigue siendo más rápida y flexible en las revisiones que su equivalente en la Unión Europea. “Los procedimientos acelerados son la nueva norma en Estados Unidos, pero en la Unión Europea los procedimientos especiales de aprobación no tienen un uso tan extendido. La situación en EEUU puede explicarse por el incremento de aprobaciones simplificadas”, ha valorado.
De todos los nuevos fármacos que recibieron autorización para ser comercializados, 30 disfrutaron de procedimientos especiales (aprobaciones condicionadas, aceleradas, innovadoras, o prioritarias). De estos 30, 18 pasaron por la FDA, 7 por la EMA y 5 por ambas agencias. En muchos casos, se concedió a un producto más de una de estas categorías especiales.
Con todo, los autores consideran que el declive en el número de aprobaciones en territorio estadounidense será aún más acusado en 2017, a pesar de que muchas compañías buscan en primer lugar la aprobación en Estados Unidos.
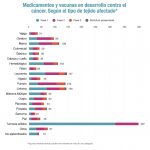
Además, las grandes compañías son las que encabezan las estadísticas de aprobación de fármacos, y la oncología es el área con mayor peso, seguida de las aprobaciones de medicamentos para enfermedades metabólicas y neurológicas, según el informe.
Johan Strömquist, director general de NDA, ha declarado que “resulta interesante ver cómo los procedimientos acelerados acaban dando forma a los datos de este año, igual que hicieron en el ejercicio anterior, pero con resultados muy diferentes”. También ha apuntado una tendencia de las compañías más pequeñas a ocupar crecientes porcentajes del mercado en términos de aprobaciones.
Las PYMES del mundo farmacéutico
Johansson también ha apuntado que se mantiene la tendencia al alza de las compañías pequeñas y de mediano tamaño a pesar de que las grandes firmas sean las que encabezan el listado de aprobaciones.
Los grandes del sector representan el 53% de las aprobaciones de 2016, mientras que las pequeñas y medianas empresas se reparten el 47% restante. Para los primeros, esto representa un descenso respecto a años previos.
Los datos acaban de presentarse en el encuentro DIA EuroMeeting, que tiene lugar estos días en Glasgow (Reino Unido). Se recabaron en las páginas de ambas agencias en enero de 2017.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 