 La Comisión Nacional de Farmacia y Terapéutica de Portugal (CNFT), órgano consultivo de la agencia portuguesa del medicamento (Infarmed) ha actualizado sus consideraciones sobre medicamentos biosimilares en un nuevo dictamen, con la recomendación de usar los biosimilares en todos los pacientes naïve y el respaldo al cambio a infliximab, etanercept y rituximab.
La Comisión Nacional de Farmacia y Terapéutica de Portugal (CNFT), órgano consultivo de la agencia portuguesa del medicamento (Infarmed) ha actualizado sus consideraciones sobre medicamentos biosimilares en un nuevo dictamen, con la recomendación de usar los biosimilares en todos los pacientes naïve y el respaldo al cambio a infliximab, etanercept y rituximab.
La CNFT considera que existen evidencias científicas suficientes para considerar que el cambio a los biosimilares de estos tres fármacos no acarreará pérdida de eficacia ni aumento del riesgo de reacciones adversas. Este criterio es válido para todas las indicaciones aprobadas para los correspondientes medicamentos biosimilares, añaden.
En cuanto al inicio de tratamientos con fármacos biológicos, la comisión indica que deberá efectuarse con la versión biosimilar o el biológico de referencia “con menor costo para la institución que lo administra”. Este criterio se establece con el objetivo de llegar a todos los nuevos pacientes.
En cuanto a quienes ya están siendo tratados con terapias biológicas, si tras la evaluación de las marcas alternativas se aprecia una oportunidad y una reducción significativa de coste, debe ponerse en marcha un proceso de cambio de medicamento al de menor coste. “Deberá ser objetivo de cada institución promover el cambio en todos los pacientes clínicamente estables”, añade el dictamen de la comisión. El proceso debe ser promovido por las comisiones de farmacia los hospitales, las administraciones regionales de salud.
No podrá realizarse el cambio en tratamientos cuya duración es inferior a seis meses. Además, habrá que informar e implicar en el proceso a todos los prescriptores y técnicos implicados: médicos, farmacéuticos y personal de enfermería.
El paciente deberá recibir explicaciones sobre el cambio de mano del prescriptor. En caso de rechazo al cambio, dicha decisión deberá ser trasladada a los servicios farmacéuticos y motivada a la CFT local, caso por caso, manteniendo la disponibilidad del medicamento que el paciente ya utilizaba.
Por otra parte, la monitorización y el registro de efectos adversos u otros acontecimientos relacionados con el nuevo medicamento, como es el caso de la aparición de signos de inmunogenicidad, deben mantenerse, pero no requieren un seguimiento adicional en relación con los medicamentos de referencia.
Por último, el dictamen aclara que la posición sobre los biosimilares de adalimumab se revisará cuando estén disponibles en el mercado nacional.




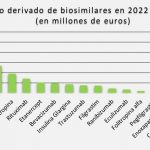
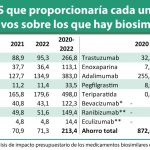













 Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.: