Miguel Ángel Calleja, José Manuel Martínez Sesmero y Belén Santiago han publicado un artículo titulado 'Biosimilares de anticuerpos monoclonales en enfermedades inflamatorias y cáncer: situación actual, retos y oportunidades' en el último número de la revista Farmacia Hospitalaria, donde calculan un ahorro de más de 2.400 millones de euros derivado de la introducción de biosimilares en el Sistema Nacional de Salud (SNS) entre 2009 y 2020.
En el texto, para cuya elaboración han contado con financiación de Amgen, empresa que comercializa biológicos originales y biosimilares, se detalla, primeramente, el proceso de aprobación de los biosimilares de anticuerpos monoclonales en la Unión Europea y, a este respecto, concluyen que "los resultados obtenidos desde 2006 avalan la estrategia de la EMA", afirmación que argumentan con el hecho de que "no se ha detectado ninguna diferencia relevante en la seguridad de los biosimilares aprobados respecto a sus biológicos originales, y ningún biosimilar se ha retirado por razones de seguridad".
Adicionalmente, se incluye el listado de medicamentos de este tipo aprobados en la UE: infliximab, rituximab adalimumab y etanercept (no es anticuerpo, pero se ha incluido por su complejidad) en enfermedades inflamatorias, y bevacizumab, trastuzumab y rituximab para oncológicas, sobre los que se centra el análisis.
En el artículo se revisan conceptos envueltos en cierta controversia, como la extrapolación, la intercambiabilidad, la sustitución y el switch. Con respecto a esta última práctica, hacen una recopilación de algunos estudios que avalan esta última práctica con anticuerpos monoclonales para enfermedades inflamatorias. En Oncología, en cambio, admiten que "la naturaleza aguda de muchas indicaciones implica un uso a corto plazo" de estos fármacos, lo que "dificulta la evaluación de switch". Esperan que vaya aumentando el número de anticuerpos monoclonales biosimilares disponibles en cáncer para que pueda generarse evidencia al respecto y consideran, mientras tanto, que "la monitorización postcomercialización, los registros y bases de datos de pacientes, y los estudios de real world evidence pueden proporcionar una información adicional valiosa sobre los diferentes patrones de switch y sus resultados".
En relación con la sustitución y el switch, destacan que en España la Orden SCO/2874/2007 impediría la sustitución automática cuando no hay un consenso previo con el prescriptor, lo que hace que los servicios de Farmacia solo puedan sustituir biológicos originales por sus biosimilares "si lo han consensuado previamente con los prescriptores en la Comisión de Farmacia y Terapéutica, y siempre deben informar al prescriptor del fármaco utilizado en cada caso". "Muchos prescriptores prefieren seguir decidiendo qué biosimilar o fármaco original se debe utilizar en cada caso, y persisten prejuicios contra el uso de biosimilares que no están justificados a la luz de la evidencia disponible", afirman. También puede ocurrir que los prescriptores favorables pueden encontrar dificultades al "comparar las diferentes ofertas de los biosimilares en todas sus posibles dimensiones", como difícil es, concluyen, "que diferentes servicios de un mismo centro lleguen a un consenso sobre la intercambiabilidad de un determinado biosimilar, especialmente cuando la disponibilidad de estudios sobre switch varía ostensiblemente entre las diferentes áreas terapéuticas".
En cuanto a los beneficios de utilizar biosimilares, explican que hay "ahorros que se pueden atribuir directamente a la adquisición" de estos productos "en lugar de biológicos originales". Y es que, prosiguen, el hecho de que las normas para el desarrollo de biosimilares les exima en muchas ocasiones de realizar estudios de fase II y, sobre todo, fase III, hace que el precio de lanzamiento estimado para los biosimilares en España sea, de media, "un 30% más bajo que el de los biológicos originales".
A esos ahorros directos suman otros indirectos, derivados, dicen, de "los requerimientos legales y la competencia". Recuerdan, en este sentido, que cuando se comercializa el primer biosimilar en España, el precio del biológico original "debe reducirse hasta, como mínimo, igualar el precio del biosimilar". Esto, indican los autores, difumina "la ventaja de precio que representaría un incentivo para el uso del biosimilar", aunque reconocen que se pueden obtener "descuentos adicionales en negociaciones posteriores o concursos públicos". Además, recuerdan que a medida que aumenta el número de biosimilares comercializados "aumenta la competencia, produciendo una bajada de precios aún mayor".
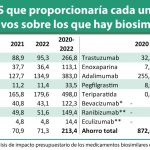
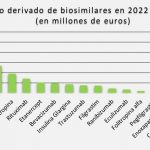
Con todo ello, concluyen que "la contribución de los biosimilares a la eficiencia del sistema sanitario es un hecho reconocido por varias sociedades médicas y farmacéuticas españolas". Citan, en este punto, "un análisis retrospectivo de datos españoles" que estima el ahorro derivado de la aparición de los biosimilares en 479 millones de euros para el periodo 2009-2016 y de 1.965 millones de euros para el periodo 2017-2020, cerca de los 2.500 millones en total. Apuntan, sobre ello, que esos ahorros suponen una liberación de recursos "que pueden invertirse en nuevos tratamientos o tecnologías sanitarias originales". Como beneficios adicionales se perciben el estímulo que suponen para la innovación en la industria farmacéutica, incluyendo en ese apartado el desarrollo de dispositivos de administración o la realización de estudios clínicos o de real world evidence adicionales.
Tras la publicación del estudio, Miguel Ángel Calleja ha subrayado que, aunque "el sólido marco regulatorio, la evidencia creciente y los resultados en vida real garantizan su utilización", es muy importante que la aplicación en los hospitales se haga "con el mayor grado de consenso entre los servicios de Farmacia y los compañeros de otras especialidades". De hecho, el estudio se llama la atención sobre el posible efecto contraproducente que pueden tener los sistemas de cuotas aplicadas en algunas comunidades autónomas, por la sensación de pérdida de libertad que pueden tener los prescriptores. Por su parte, José Manuel Martínez Sesmero ha calificado a los biosimilares como "un revulsivo de alto valor en la optimización de la gestión de recursos sanitarios", por los ahorros en costes y el estímulo que suponen para la innovación y la investigación de resultados en salud.













 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: