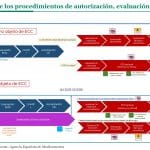
La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) va a comenzar a trabajar en los informes de posicionamiento terapéutico (IPT) de los medicamentos que han obtenido una opinión positiva por procedimiento centralizado en la reunión del Comité de Medicamentos de Uso Humano (CHMP, por sus siglas en inglés) de la Agencia Europea de Medicamentos (EMA), celebrada en junio de 2024. Estos IPT corresponden tanto a los nuevos medicamentos como a las nuevas indicaciones o modificaciones de estas que han obtenido el visto bueno del comité y que están abajo descritas.
En el caso de los nuevos medicamentos, el proceso de elaboración de los IPT comenzará en el momento en el que la Aemps reciba, por parte del titular de autorización de comercialización (TAC), la comunicación de la intención de comercializar estos medicamentos en España y la solicitud del código nacional. Para ello, la Agencia solicita a los TAC que contacten con ipt@aemps.es, indicando lo siguiente:
Su intención o no de comercialización en España de los nuevos medicamentos que hayan obtenido opinión positiva por procedimiento centralizado. En caso afirmativo, deberán solicitar el código nacional a través de la aplicación de Raefar II, tal y como indica esta guía.
En caso de que la Aemps no reciba confirmación de comercialización y que, por tanto, el TAC no solicite el código nacional para los nuevos medicamentos, no se comenzará la elaboración del IPT correspondiente.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 