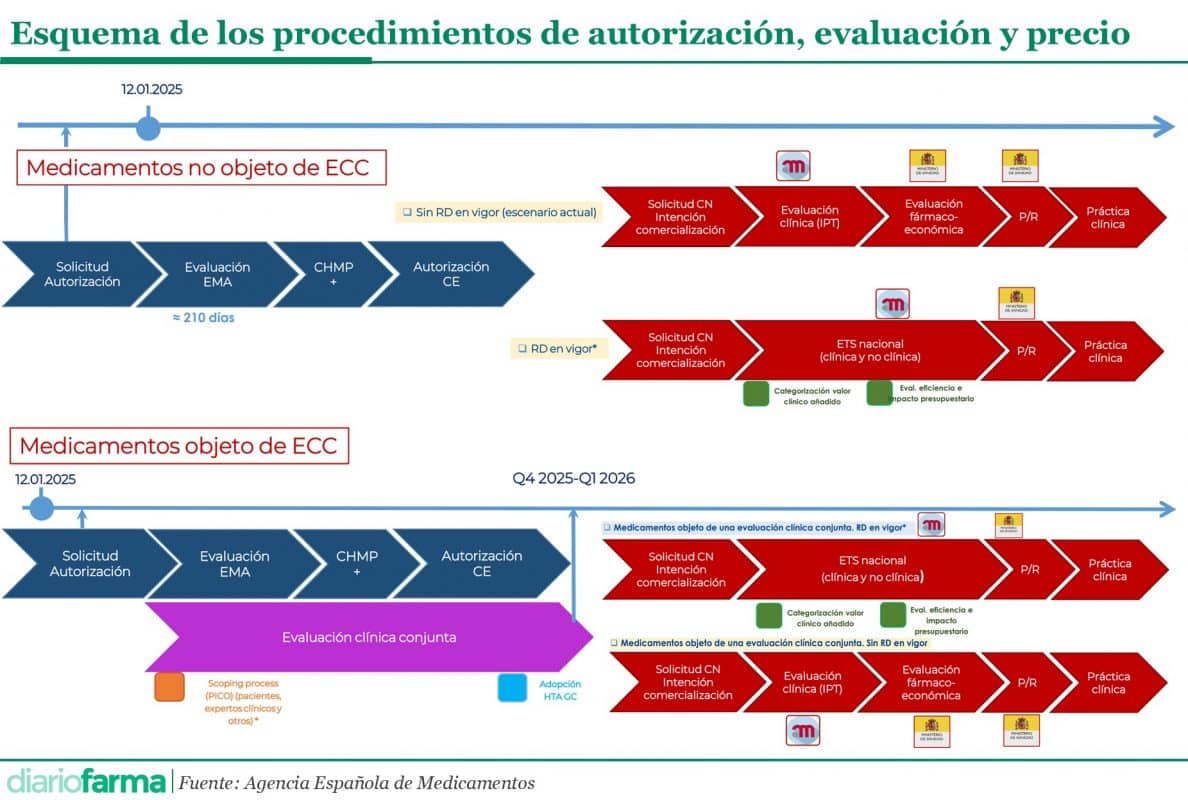
En la actualidad, estamos inmersos en una modificación de la normativa y los procedimientos de evaluación de medicamentos, tanto en Europa como en España. El pasado 12 de enero marcó el inicio de la vigencia de las evaluaciones clínicas conjuntas (JCA, por sus siglas en inglés). A partir de esa fecha, las solicitudes de autorización de nuevos medicamentos oncológicos o de terapia avanzada deben tramitarse conforme al Reglamento de HTA europeo.
Paralelamente, en España se está tramitando el Real Decreto de Evaluación de Tecnologías Sanitarias (ETS), cuya aprobación por el Consejo de Ministros se espera en los próximos meses. Mientras tanto, y en especial por si este periodo se prolonga, la Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ya trabaja en cuatro posibles escenarios de evaluación, dependiendo de si el medicamento está sujeto a evaluaciones clínicas conjuntas y si el Real Decreto de ETS está en vigor.
Sin evaluación clínica conjunta
En el caso de medicamentos que no sean objeto de evaluación clínica conjunta (es decir, aquellos que no son oncológicos o de terapia avanzada) y si el Real Decreto aún no estuviera en vigor, la evaluación continuaría según el proceso vigente. Esto implicaría que, tras la solicitud de código nacional por parte del laboratorio a la agencia, se procedería a la elaboración del Informe de Posicionamiento Terapéutico (IPT). Posteriormente, la Dirección General de Cartera Común de Servicios del Sistema Nacional de Salud y Farmacia (DGCCSF) discutiría la propuesta de evaluación farmacoeconómica presentada por la compañía, que contribuiría a la decisión sobre el precio para la incorporación del medicamento en la práctica clínica.
En caso de que el Real Decreto de ETS ya estuviera en vigor, tras la solicitud de código nacional, la Aemps iniciaría la evaluación de tecnologías sanitarias a nivel nacional, abarcando tanto la parte clínica como la no clínica. Según el borrador del Real Decreto, habría un plazo de 90 días para elaborar los informes a partir de la autorización de comercialización. La definición clara de este plazo, así como el reparto del mismo entre la evaluación clínica y la no clínica, es una de las cuestiones planteadas por los agentes del sector. Una vez completado este proceso, se decidiría el precio y se procedería a la incorporación del medicamento en la práctica clínica.
Con evaluación clínica conjunta
Para los medicamentos obligados a someterse a una JCA, la elaboración del informe comenzará una vez que el laboratorio presente su solicitud a la Agencia Europea de Medicamentos (EMA). Este proceso se llevará a cabo en paralelo con la evaluación de la EMA, y se espera que los primeros JCA estén disponibles a finales de 2025 o principios de 2026. Una vez que el medicamento sea recomendado por la EMA y autorizado por la Comisión Europea, se iniciará la fase nacional, que también estará condicionada por la vigencia del Real Decreto de ETS.
Si el Real Decreto ya está en vigor, a partir del escrito de intención de comercialización presentado por el laboratorio se completará la evaluación a nivel nacional, cubriendo tanto la parte clínica como la no clínica. En este caso, los plazos estimados son de 20 días para la evaluación clínica y 90 días para la no clínica. Estos informes, una vez finalizados, serán proporcionados a los responsables para la decisión sobre el precio y la incorporación a la práctica clínica.
Por el contrario, si el Real Decreto no estuviera en vigor a finales de 2025 o principios de 2026, el proceso continuaría de acuerdo con los procedimientos actuales de la Aemps y la DGCCSF.
Esta multiplicidad de escenarios implica una importante carga de trabajo para la Aemps ya que, además, al participar en la elaboración de JCA, debe destinar recursos a esas evaluaciones que son mucho más exigentes que las realizadas hasta el momento.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: