“El Proyecto de Real Decreto es una oportunidad para desarrollar un marco de evaluación de tecnologías sanitarias en España que sea referente en Europa por su calidad, agilidad y sensibilidad con la innovación”, así valoran desde Asebio, la función y el objetivo del Proyecto de Real Decreto (RD) por el que se regula la evaluación de tecnologías sanitarias (ETS), al cual acaban de presentar sus propuestas para desarrollarlo.
El pasado 12 de agosto el Ministerio de Sanidad publicaba el borrador e iniciaba el trámite de audiencia e información pública relativo al Proyecto de Real Decreto (RD) por el que se regula la evaluación de tecnologías sanitarias (ETS). Este Proyecto de Real Decreto regula la evaluación de tecnologías sanitarias, que incluye medicamentos, procedimientos médicos, productos sanitarios, pruebas para el diagnóstico ‘in vitro’ y otras tecnologías relacionadas con la salud.
España “debe aspirar a que sus empresas biotecnológicas crezcan y sean capaces de llevar sus innovaciones al paciente”, para ello, aseguran desde la entidad se “requiere de un marco de ETS ágil y navegable para este tipo de empresas”.
El ecosistema biotecnológico español está constituido por un 96% de empresas que son micropymes y pymes para las que la implantación de la ETS supone un reto. En este sentido y tras el análisis realizado desde la asociación, solicitan que se tengan en cuenta las características específicas del sector biotecnológico a través de distintas medidas que no sólo faciliten a las pequeñas compañías biotech acceder y atravesar el procedimiento adecuadamente, sino que eviten que el sistema para las ETS suponga una barrera o dificultad añadida. De este modo, España se posicionaría como un mercado de preferencia para el lanzamiento de sus innovaciones, con el consiguiente impacto positivo para los pacientes, la atracción de inversores y la innovación.
A este respecto, proponen medidas como facilitar el acceso de pymes y micropymes españolas a las consultas de asesoría, la exención de tasas para tramitar la ETS; o un fast track para la evaluación de productos que se desarrollen de principio a fin a nivel nacional, entre otras.
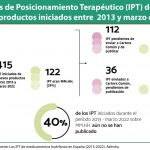
El Proyecto de Real Decreto declara buscar separar la evaluación de las decisiones de financiación mediante la creación de entidades independientes. En este contexto, las "Oficinas para la evaluación de la eficiencia de las tecnologías sanitarias" realizan las evaluaciones, mientras que el Grupo de Posicionamiento de Tecnologías Sanitarias (GPTS) conecta las evaluaciones con la toma de decisiones. Sin embargo, los miembros del GPTS son los mismos que participan en las decisiones de precio y reembolso, lo que compromete la independencia.
Desde Asebio, “abogamos por garantizar y reforzar la independencia del proceso de evaluación, desarrollando en el RD exclusivamente los aspectos relacionados con el procedimiento de evaluación. De esta forma, en consonancia con el papel del GPTS, que se configura como un grupo de preparación de la decisión, su desarrollo se realizaría a través del futuro RD de Precio y Financiación (P&F)”.
Además plantean la presencia de la industria en el Consejo de Gobernanza, y participación de las empresas en aquellos procedimientos en los que tengan la condición de parte interesada
Entre las alegaciones presentadas por Asebio destacan “la necesidad de que la industria tenga presencia y voz en el Consejo de Gobernanza mediante la inclusión de representantes en la Gobernanza del sistema de evaluación. El órgano superior de supervisión incluye representantes del Ministerio de Sanidad, comunidades autónomas, profesionales sanitarios, economistas de la salud, pacientes y consumidores, pero no a la industria. Hecho que deja fuera a una parte interesada fundamental”.
Como parte interesada en la evaluación de los productos desarrollados por ellas, las empresas “deberían tener derecho a conocer el estado de la tramitación de los procedimientos, así como a plantear alegaciones, recursos administrativos y judiciales”.
Por último, en relación con la aportación de costes de investigación y desarrollo plantean "eliminar las referencias a la información de costes fidedignos de producción, investigación y desarrollo, así como de las fuentes de financiación de estos costes, públicas o privadas”. Consideran que la exigencia de comunicar costes detallados de producción es compleja, por un lado, y, por otro lado, sin utilidad alguna para la evaluación clínica y no clínica (objeto de este RD) el valor de los medicamentos.
Asebio valora “positivamente la oportunidad que este Proyecto de Real Decreto supone para desarrollar un marco de evaluación de tecnologías sanitarias en nuestro país referente para Europa, y que contribuya al desarrollo y crecimiento del tejido español de empresas biotecnológicas” y agradece al Ministerio de Sanidad “el tenernos en cuenta de cara a mejorar este Proyecto de Real Decreto y ponemos a su disposición nuestra experiencia y profundo conocimiento del sector biotecnológico”.

















 :
:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.:  Javier Padilla, secretario de Estado de Sanidad:
Javier Padilla, secretario de Estado de Sanidad: