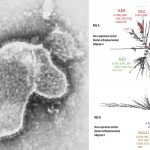
La compañía Hipra confía en que la Agencia Europea del Medicamento autorice su registro de comercialización para el próximo mes de noviembre y comenzar a distribuir las primeras dosis de su vacuna proteica antes de finalizar el año.
Así lo ha asegurado este martes la vicepresidenta Ejecutiva, EliaTorroella, quien además ha indicado que antes del final de este mes de octubre, el laboratorio presentará ante el regulador europeo los últimos datos solicitados para concluir la evaluación de su suero.
El objetivo de Hipra es conseguir que “nuestra vacuna pueda formar parte de la campaña de vacunación antes de fin de año, tanto en España, como en el resto de los países europeos”.
Hipra cerró el pasado mes de agosto un acuerdo con la Comisión Europea de derecho a compra para asegurar un suministro de 240 millones de dosis. 14 Estados miembro han mostrado su interés por adquirir estas vacunas, que tendrán un precio unitario “por debajo de los 10 euros”, según ha indicado el también vicepresidente ejecutivo de la compañía, Carlos Morales.
Además Hipra también ha establecido contacto con Estados Unidos y varios países hispanoamericanos para la adquisición de su vacuna.
Aunque la EMA está examinando la vacuna de Hipra como suero de refuerzo para administrar a partir de los 16 años, la compañía está desarrollando estudios que le permitan desarrollar ensayos pediátricos, una vez cuente con la autorización de comercialización en la Unión Europea.















 Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.: