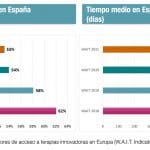
Cal y arena en el estudio Waiting to Access Innovative Therapies (WAIT) correspondiente a 2023 para España. El informe, elaborado por IQVIA para la Federación Europea de la Industria Farmacéutica (Efpia), al que ha tenido acceso Diariofarma, muestra cómo en nuestro país hay que esperar hasta 661 días de media para la decisión de financiación desde el otorgamiento de la licencia de autorización de comercialización por parte de la Comisión Europea. La cifra resultante es un mes más que en el informe previo (629 días), en concreto 32 días, lo que supone un empeoramiento del 5,1%.
En lo que sí ha mejorado nuestro país es en la tasa de disponibilidad de innovaciones. En España a 1 de enero de 2024 estaban disponibles, sin contar los autorizados bajo el mecanismo de situaciones especiales, 103 de los 167 medicamentos aprobados entre 2019 y 2022, lo que coloca a nuestro país en la octava posición europea. Esto supone el 62%, cifra sensiblemente superior a la registrada en el informe anterior, que cifró en el 58% las innovaciones autorizadas entre 2018 y 2021 y que estaban disponibles en enero de 2023. A lo largo de los últimos años se ha observado un progresivo avance en este parámetro que, no obstante, queda muy lejos de alcanzar las cifras registradas en Alemania, con una disponibilidad de innovaciones del 88% o Italia (77%).
La contrapartida es que ese mayor número de medicamentos disponibles sufre la aplicación de restricciones sobre la ficha técnica una vez que se autoriza su uso en el Sistema Nacional de Salud. De este modo, en el WAIT 2023 ha crecido ligeramente la proporción de medicamentos innovadores con alguna restricción, hasta alcanzar el 52%, un punto porcentual más que en 2022. Esto supone que, de los 103 nuevos medicamentos, unos 52 tienen algún tipo de restricción. Esta circunstancia sitúa a nuestro país entre los 10 que más limitan el uso de los nuevos medicamentos de entre los 36 que analiza IQVIA en este informe.
La falta de disponibilidad y la aplicación de restricciones hace que en España solo estén totalmente disponibles el 29% de las innovaciones autorizadas a nivel europeo, lo que nos sitúa, junto a Dinamarca, como el decimotercer país en disponibilidad sin restricciones.
Mercado oncológico y de huérfanos
Analizando el mercado oncológico de forma aislada, nuestro país tiene disponibles 29 de los 48 medicamentos innovadores autorizados, lo que supone un 69% del total. De ellos, el 42% lo están de forma completa, mientras que un 29% tienen alguna limitación. La espera hasta autorización de estos medicamentos es más elevada que para el total, ya que alcanza los 725 días, un importante incremento del retraso, de casi un 20%, frente a los 611 registrados en el WAIT 2022.
Por su parte, en lo que se refiere a los medicamentos huérfanos, en España están disponibles 32 de los 63 medicamentos indicados para enfermedades raras aprobados entre 2019 y 2022, contando con disponibilidad total el 56%, mientras que el 44% restante tiene alguna restricción. De este modo, solo el 29% de los huérfanos innovadores llegan a España sin limitaciones de uso frente a la autorización europea. En cuanto al tiempo hasta la disponibilidad ha mejorado para estos productos y se encuentra en los 704 días frente a los 786 días del informe previo, lo que supone una reducción del 10%.
Respecto del resto de medicamentos, España tiene disponibles 24 de las 47 innovaciones aprobadas entre 2019 y 2022, de las que el 46% cuentan con una disponibilidad completa de la ficha técnica. En este caso, se ha observado una importante mejora de los plazos para la disponibilidad, al pasar de 814 días en el informe de 2022 a 641 en este último, es decir, una mejoría del 21%.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: