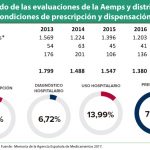
El jefe de la Unidad de Farmacoepidemiología y Farmacovigilancia de la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), Miguel Ángel Maciá, aprovechó su participación en la Jornada Científica de la Sociedad Española de Farmacología Clínica (SEFC) para informar de los trabajos que se vienen realizando en el seno del Comité de Coordinación de Estudios Postautorización, compuesto por un representante de la Aemps y uno de cada comunidad autónoma, con el fin de elaborar un nuevo Real Decreto que sirva para poner un poco de orden en este ámbito. El objetivo, asegura, es "la simplificación
Y es que, señala Maciá, algunos de estos estudios "van más allá de observar el funcionamiento de los medicamentos y pueden influir en cómo se usan, alterando así el curso normal de la práctica clínica". Por eso, la intención es que el RD proporcione las herramientas para "ser capaces de detectarlos, sobre todo porque las CCAA, que son las que sufragan el coste de los medicamentos, tienen el temor de que se hagan estudios con poco valor científico y que fomenten un uso excesivo o inadecuado de determinados fármacos".
La idea es establecer un procedimiento por el cual sea el citado Comité, que podría ver modificado su nombre y algunas de sus funciones actuales, en coordinación con el Comité Ético de Investigación con Medicamentos, el encargado de dar el visto bueno al protocolo del estudio en cuestión, validándolo así para que pueda realizarse en todo el Estado español. A partir de ahí, será cada centro y cada CCAA, en cumplimiento de sus competencias, los que determinen la idoneidad de acoger dicho estudio, en función de si el fármaco se utiliza, si está incluido en la prestación o por cualquier otro motivo de ámbito local.
Actualmente, los promotores de la iniciativa regulatoria están, según Maciá, "trabajando con un borrador", el cual está siendo discutido con las autonomías en el seno del Comité de Coordinación. No obstante, el documento estaría "bastante avanzado" y a la espera de que el área jurídica de la Aemps de luz verde para pasar a fases más formales. La intención, en todo caso, sería la de poder aprobar la nueva normativa a lo largo de 2018, para lo cual, primero, el Ministerio de Sanidad tendrá que hacer público su intención de iniciar una revisión de la actual regulación, para después someter el borrador a audiencia pública.
La visión de la industria, a través de Lilly
En la misma jornada participó José Antonio Sacristán, director Médico de Lilly, quien hizo hincapié en la revolución que está suponiendo la generación y explotación de macrodatos (Big Data) y, más concretamente, el potencial que tiene la integración de la investigación clínica con la práctica médica. En este sentido, pone como ejemplo "los estudios de registros aleatorizados, consistentes en la inclusión de unos módulos para investigación en la historia clínica electrónica, de modo que el médico pueda ir registrando datos y convertirlos en estudios observacionales".
El principal interés de estas nuevas prácticas está, dice, en la posibilidad que ofrecen "para comprobar que los medicamentos funcionan igual en la práctica habitual que en los ensayos clínicos, que es el gran caballo de batalla al que las compañías nos enfrentamos en la actualidad. Asimismo, nos pueden ayudar a ver cuál es la mejor forma de utilizar un medicamento", señala.
En opinión de Sacristán, la generalización de estos estudios y su toma en consideración está todavía en "fase incipiente", aunque reconoce igualmente que "cada vez hay mayor interés por parte de todos los agentes: los reguladores, que empiezan a pedir estos datos de forma habitual; los financiadores, porque son fundamentales para la aplicación de esquemas riesgo compartido y pago por resultados, y la industria, que también está interesada en hacer una evaluación continua". Por eso, piensa que aunque ahora la realidad está marcada por estudios piloto para ver si estos esquemas funcionan, "en cinco años esto va a ser la norma y se va a consolidar la necesidad de realizar estrechos seguimientos postautorización"
De cara a ese futuro, Sacristán es de los que piensa que habría que modular los requisitos relacionados con el consentimiento de los pacientes para proteger la confidencialidad y la privacidad en función del riesgo que entrañe cada estudio. Asimismo, le parece fundamental avanzar en la interconexión de datos entre sistemas regionales de salud, "ya que no es lógico que hablemos de globalización y Big Data y las CCAA sigan teniendo sistemas independientes e incompatibles entre sí".
Por la parte de la industria, reconoce que el interés es creciente y, concretamente su compañía ha empezado a diseñar estudios postautorización, y ya cuentan un total de cuatro a partir de registros de pacientes.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: