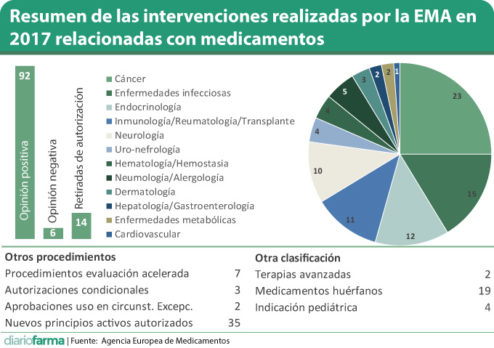
La Agencia Europea del Medicamento (EMA) ha hecho público su balance de actividad en 2017, año en el que ha emitido 92 recomendaciones positivas, 35 de ellas sobre nuevos principios activos, seis opiniones negativas, 51 extensiones de indicación y 14 órdenes de retirada de fármacos.
De los dictámenes positivos, cabe destacar la prevalencia de las emitidas en el área de cáncer (23), en línea con las previsiones de consultoras como IQVIA, que vienen avanzando desde hace tiempo que ésta sera, sin duda, una de las que más contribuirá al incremento del gasto en los próximos años, aunque eso pueda ir acompañado, también, de mejores resultados para los pacientes.
Por detrás de las recomendaciones de aprobaciones de tratamientos oncológicos aparecen las relacionadas con fármacos para enfermedades infecciosas (15), Endocrinología (12), Inmunología/Reumatología/Transplante (11), Neurología (10), Neumología/Alegología (5), Uro-nefrología (4), Hematología/Hemostasia (4), Dermatología (3), Hepatología/Gastroenterología (2), enfermedades metabólicas (2) y sistema cardiovascular (1).
La EMA también clasifica sus opiniones positivas en función del impacto que tienen para la salud pública y, en este sentido, destaca la recomendación de aprobación para cuatro medicamentos para uso pediátrico, dos de ellos en Neurología y otros dos en Endocrinología, así como 19 indicaciones huérfanas y dos nuevas terapias avanzadas.
Acceso temprano
Además de los procedimientos habituales, ya se sabe que la EMA está tratando de acortar tiempos para favorecer el acceso temprano a tratamientos que vienen a cubrir lagunas terapéuticas. En esta línea, han confirmado la recomendación por procedimiento acelerado (plazo máximo de 150 días) para un total de siete medicamentos en las áreas de Neurología, enfermedades infecciosas y Gastroenterología.
También se han concedido autorizaciones condicionales para tres medicamentos, dos en Endocrinología y uno en cáncer (en todos ellos las compañías están obligadas a completar los dossieres con los datos de estudios en marcha u otros nuevos), y dos aprobaciones en circunstancias especiales, en cáncer y Neurología, "ante la imposibilidad de alcanzar los estándares de investigación clínica por el número reducido de pacientes".
Otras acciones
Además de todo lo dicho, la EMA informa de los resultados de la monitorización de los medicamentos ya comercializados, junto con las autoridades estatales, para controlar la calidad y el mantenimiento de un buen equilibrio entre el beneficio y el riesgo. "Las medidas aquí van desde la modificación de la información que acompaña al producto hasta la retirada de un medicamento del mercado o de los lotes que se hayan visto afectados", informan. En total, 14 medicamentos fueron retirados por estas razones, a lo que habría que sumar un buen número de restricciones de uso que vienen detalladas en el informe.
El informe también recoge algunas actuaciones de la Agencia, en relación con los procesos de fabricación de los medicamentos, "que deben ajustarse, independientemente de dónde tenga lugar la producción, a los estándares europeos". En este sentido, alude a la retirada de dos autorizaciones de comercialización por el incumplimiento de las Buenas Prácticas de Fabricación (GMP) y una más por no cumplir con lo marcado para la investigación clínica (GCP). Asimismo, hace referencia a la retirada de lotes, opiniones negativas, entre otras acciones.
Finalmente, la EMA se refiere al proceso de consulta pública, en la que han participado pacientes, cuidadores, médicos, farmacéuticos y académicos, para determinar el perfil de riesgo de valporate, un fármaco que se usa para tratar la epilepsia, trastorno bipolar y la migraña, cuando se aplica a mujeres embarazadas, ya que está asociado a riesgos de malformación en el feto. "Cuando concluya la revisión, la EMA publicará un informe con medidas para reducir dicho riesgo", concluyen.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: