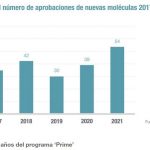
La Agencia Europea de Medicamentos (EMA) ha hecho público su informe anual, del que destaca la recomendación positiva para la comercialización de un total de 84 medicamentos, de las cuales, 42 afectaban a principios activos inéditos. Por áreas terapéuticas, el cáncer sigue aglutinando la mayor parte de las decisiones de la Agencia, siendo 11 de 23 los productos realmente novedosos, seguido de las enfermedades infecciosas (6/11), la neurología (5/10), y la hematología (6/9). También hay novedades en imunología/reumatología y trasplantes (1/7), endocrinología (4/6), metabolismo (3/5), neuomología/alergología (2/5), vacunas (2/3), cardiovascular (0/1), hepatología/gastroenterología (1/1), oftalmología (1/1), medicina reproductiva (0/1) y uro-nefrología (0/1).
El Comité de Medicamentos de Uso Humano (CHMP), responsable de la emisión de estas recomendaciones, solo desestimó cinco solicitudes, mientras que otras 10 fueron retiradas por los propios laboratorios antes del dictamen, al considerar que los datos aportados eran insuficientes. La EMA apunta que, del total de las opiniones positivas asignadas, el 69% habían recibido asesoramiento durante la fase de desarrollo clínico.
Dentro de los datos de su informe anual, la Agencia también destaca la asignación de una nueva autorización condicional, en esta ocasión para Rubraca, medicamento oncológico, de la cual se desprende, no obstante, la necesidad de que el titular complete la evidencia disponible con datos postautorización, ya que esta aprobación se concede, recuerdan, con menos datos de los que requeridos habitualmente. La excepción se debe, explican, a que este medicamento "viene a cubrir una necesidad terapéutica no cubierta", ofreciendo una alternativa a pacientes que hasta ahora no la tenían. Concretamente, está indicado en cáncer de alto grado de ovario, trompas de Falopio y peritoneo que hayan recibido previamente dos líneas de tratamiento a base de platino y no puedan recibir más.
En relación con las autorizaciones condicionales, una modalidad que la EMA comenzó a utilizar en 2016, indican que, de las 38 a las que se les ha concedido, 19 han terminado obteniendo la autorización de comercialización ordinaria. El pasado año, concretamente, ocurrió con Blyncito, tratamiento de un tipo de leucemia linfoblástica aguda, que obtuvo la autorización definitiva tras completar los datos que le faltaban. De media, indican desde la EMA, "este proceso se alarga durante unos cuatro años para las compañías".
Sobre los procedimientos de evaluación acelerada
Otra modalidad que también se ha comenzado a extender es la de la recomendación de aprobación siguiendo un procedimiento de evaluación acelerada. En total, fueron cuatro los productos que recibieron el visto para su autorización tras pasar por un procedimiento de estas características en 2018, año en el que se aceptaron 11 solicitudes de compañías para operar por esta vía y se rechazaron otras 13. "Las principales razones para la denegación fueron la falta de justificación de la necesidad no cubierta, así como las carencias en lo relativo a la justificación del interés público", apuntan.
Precisamente, la EMA hace un repaso también por los tiempos de aprobación, desde que el CHMP recibe la solicitud hasta que la Comisión Europea concede la autorización definitiva. A este respecto, informan de que la media se situó en 2018 en los 440 días, una cifra superior a la registrada en años anteriores. En este sentido, destacan, por un lado, los 198 días de media que tarda el CHMP en emitir su primer dictamen (ha crecido con respecto a 2017 y 2014, aunque es muy similar a 2015 y 2016), a los que hay que sumar los 184 días (ésta cifra ha crecido considerablemente en el último año), de media, que emplean las compañías en la aportación de información adicional o clarificar algunos aspectos, cuando éstas son requeridas por la EMA. En cuanto a la decisión de la CE, esta suele demorarse unos 53 días, un plazo que se ha mantenido más o menos estable.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: