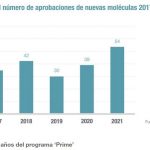
La Agencia Europea del Medicamento (EMA) ha hecho ya oficial el informe sobre recomendaciones de comercialización de fármacos que avanzó a mediados de este mes. El resultado representa una gran satisfacción para la industria farmacéutica, según expresan desde Farmaindustria. En total, en 2024 la que refleja cómo en el pasado 2024 la EMA recomendó la autorización de comercialización de 114 EMA aprobó 114 medicamentos, de los que 46 son opciones terapéuticas novedosas ya que contienen un principio activo nuevo que nunca antes había sido autorizado en la Unión Europea. Además, hasta 15 de los nuevos medicamentos lo son para enfermedades consideradas raras o poco frecuentes.
Los 46 nuevos medicamentos del último año suponen siete más que los 39 aprobados en 2023 y está en la media de las innovaciones aprobados cada año, ya que la EMA ha aprobado algo más de 200 nuevos principios activos en los últimos cinco años.
La propia Agencia Europea de Medicamentos resalta en su informe anual Human Medicines in 2024 que entre los nuevos tratamientos aprobados “hay una serie de medicamentos que destacan por su contribución a abordar necesidades de salud pública o por la evidente innovación que suponen”. En el área de la neurología destacan el nuevo medicamento dirigido para el tratamiento del Alzheimer temprano y otro para el tratamiento de adultos con un tipo de esclerosis lateral amiotrófica (ELA); tres medicamentos para enfermedades raras en el área de hematología: una terapia génica para el tratamiento de la hemofilia B; un medicamento para la hemoglobinuria paroxística nocturna; y la primera monoterapia para la anemia hemolítica en los pacientes con hemoglobinuria paroxística nocturna. Además, en el área cardiovascular se aprobó un medicamento para la hipertensión arterial pulmonar, también considerada una patología poco frecuente.
También se destacan en el informe la aprobación de 6 medicamentos con la denominación PRIME (Priority Medicines), lo que significa que van dirigidos a necesidades médicas no cubiertas en enfermedades que aún no tienen tratamiento efectivo. “El programa PRIME tiene como objetivo ayudar a los pacientes a beneficiarse lo antes posible a partir de medicamentos prometedores dirigidos a una necesidad médica insatisfecha”, resalta Isabel Pineros, directora del Departamento de Prestación Farmacéutica y Acceso de Farmaindustria. “Para este tipo de medicamentos, y para los que suponen una evidente ventaja terapéutica, se hace necesario un procedimiento especial de financiación que permita a los pacientes beneficiarse de las innovaciones de forma urgente, como recoge la Propuesta para el acceso temprano a los medicamentos innovadores de Farmaindustria”.
Además, la EMA resalta en su informe la aprobación de otros tres tratamientos por su innovación: la primera forma de adrenalina sin agujas y de menor tamaño para tratar reacciones alérgicas, el primer tratamiento para tumores asociados a la enfermedad de von Hippel-Lindau y una nueva combinación de antibióticos para el tratamiento de infecciones graves.
Por otro lado, en 2024 se recomendaron 90 extensiones de indicación, de las que 40 son extensiones de medicamentos para uso pediátrico que ya están autorizados en adultos, poniéndose de relevancia la apuesta de las compañías farmacéuticas de incluir en la innovación terapéutica y adaptar los medicamentos para los pacientes pediátricos
En cuanto a áreas terapéuticas, la oncología fue el área con mayor número de nuevos medicamentos innovadores, con 13 aprobaciones, seguida de la hematología, que tuvo hasta 10 nuevos principios activos, de los que cuatro fueron para enfermedades raras de la sangre. También destacó el área cardiovascular, con la llegada de tres medicamentos con nuevos principios activos.
También fue un buen año en cuanto a la innovación en vacunas. La Agencia europea destaca en este caso la recomendación de aprobación de varias vacunas nuevas, incluida una para proteger contra la enfermedad de Chikungunya y una nueva vacuna de ARNm contra la enfermedad del tracto respiratorio inferior causada por el virus respiratorio sincitial (VSR), además de la ampliación del uso de una vacuna mpox (viruela del mono) para proteger a los adolescentes de 12 a 17 años.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: