El procedimiento para fijar precio y financiación pública de lo medicamentos “se ha hecho cada vez más lento e impredecible”, asegura Farmaindustria y ello está provocando “un importante retraso en el acceso de los españoles a nuevos tratamientos que repercute directamente en la calidad del sistema sanitario”.
Para revertir esta situación “es necesario mejorar el procedimiento actual para garantizar que las evaluaciones clínica y económica sean más objetivas, transparentes, participativas y predecibles”, explicó Humberto Arnés, director general de Farmaindustria, en un coloquio dedicado a la Innovación y proceso de aprobación en España, en el marco de la segunda edición de la ECO Lung Summit sobre grandes avances en el abordaje del cáncer de pulmón que organiza la Fundación para la Excelencia y la Calidad de la Oncología (Fundación ECO).
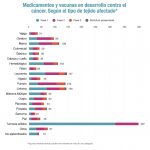
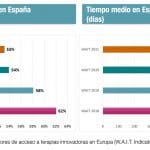
Arnés recordó que, de acuerdo con los datos del estudio WAIT de 2020, realizado por la consultora Iqvia, de cada cien medicamentos autorizados por la Agencia Europea de Medicamentos (EMA), los pacientes españoles tienen acceso a 54 de ellos. En el caso de la oncología, esta disponibilidad en España es del 59%, mientras que en Italia y Francia es del 80% y en el Reino Unido, del 88%. “Comparándonos con los cinco principales países europeos vemos que en el nuestro el acceso a los medicamentos oncológicos es peor. La no disponibilidad o los retrasos en la toma de decisión suponen una pérdida de oportunidad para los pacientes, que en algunos casos ya no podrán beneficiarse de esos nuevos medicamentos”, afirmó.
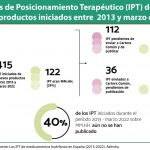
Ante la pregunta sobre el uso de los informes de posicionamiento terapéutico (los conocidos como IPT) como instrumento para la evaluación de la innovación, Arnés lamentó que mezclen “indebidamente” la evaluación clínica y la económica. “Hay que hacer las dos, pero por separado y por equipos independientes”, señaló, en una respuesta compartida por todos los expertos que participaron en el coloquio.
“La evaluación económica debe basarse en el precio ofertado por la compañía y tener una perspectiva social, es decir, incorporando todos los beneficios y costes sanitarios y no sanitarios, no sólo el impacto sobre el presupuesto farmacéutico. Por su parte, el posicionamiento terapéutico de un producto tiene que ver con su aportación en términos de beneficio clínico añadido. Sólo así puede posicionarse un medicamento en terapéutica: según su valor clínico”, explicó.
En este sentido, el director general de Farmaindustria se sumó a las declaraciones de los expertos clínicos participantes en el debate, que pusieron de relieve que los clínicos no intervienen en estos momentos suficientemente en el proceso de evaluación de medicamentos, por lo que sugirió que fueran incluidos desde el inicio en la elaboración de los IPT. “La colaboración con los clínicos, que son los que tienen el conocimiento de la patología y el manejo del paciente, sólo puede redundar en una mejor valoración del medicamento y, por tanto, en que la toma de decisiones a posteriori esté mejor motivada”, subrayó.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 