El Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea del Medicamento (EMA) ha recomendado este jueves la concesión de una autorización de comercialización condicional para el medicamento antiviral oral Paxlovid, de la compañía farmacéutica Pfizer, para el tratamiento de la covid en adultos que no requieren oxígeno suplementario y que tienen un mayor riesgo de que la enfermedad se agrave.
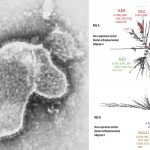
Paxlovid es el primer medicamento antiviral de administración oral recomendado en la UE para el tratamiento de la COVID-19. Contiene dos sustancias activas, PF-07321332 y ritonavir, en dos comprimidos diferentes. El PF-07321332 actúa reduciendo la capacidad del SARS-CoV-2 de multiplicarse en el organismo, mientras que el ritonavir prolonga la acción del PF-07321332, lo que le permite permanecer más tiempo en el organismo a niveles que afectan a la multiplicación del virus.
Según ha informado el regulador europeo en un comunicado, el CHMP evaluó los datos de un estudio que mostraba que el tratamiento con este medicamento reduce significativamente las hospitalizaciones o los fallecimientos en pacientes que tenían al menos una enfermedad subyacente que los ponía en riesgo de padecer covid.
El análisis se realizó en pacientes que recibieron Paxlovid o placebo en los 5 días siguientes al inicio de los síntomas y que no recibieron, ni se esperaba que recibieran, tratamiento con anticuerpos. Durante el mes siguiente al tratamiento, el 0,8% (8 de 1.039) de los pacientes que recibieron Paxlovid fueron hospitalizados durante más de 24 horas, en comparación con el 6,3% (66 de 1.046) de los que recibieron placebo. No hubo ninguna muerte en el grupo de Paxlovid y 9 en el grupo de placebo.
El antiviral redujo el riesgo de hospitalización o muerte en un 89% en los tres días siguientes al inicio de los síntomas y en un 88% en los cinco días siguientes al inicio de los síntomas en comparación con el placebo.
La mayoría de los pacientes del estudio estaban infectados con la variante Delta. El laboratorio espera que Paxlovid también sea activo contra la variante ómicron y otras futuras.
A pesar que la EMA recuerda que “ritonavir afecta a la acción de muchos otros medicamentos”, y por ello se han incluido advertencias y consejos en la información del producto, el CHMP ha concluido que los beneficios del medicamento “son mayores que sus riesgos para el uso aprobado” y ahora enviará sus recomendaciones a la Comisión Europea para que tome una decisión sobre su aprobación en todos los Estados miembros de la UE.

















 Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados: