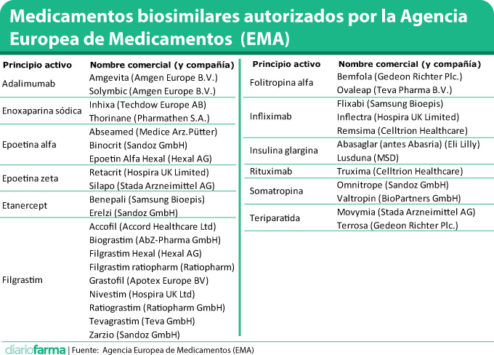
La Comisión Europea ha aprobado la comercialización de Erelzi, el biosimilar de etanercept desarrollado por Sandoz. Con esta autorización, el número de biosimilares comercializados en Europa se eleva a 29 medicamentos de doce principios activos diferentes.
Con esta autorización Sandoz sigue liderando el mercado mundial de biosimilares al disponer de cinco productos autorizados actualmente en Europa, incluyendo biosimilares de algunos de los biológicos más vendidos del mundo. Además, la compañía planea lanzar tres biosimilares más en el área de oncología e inmunología en 2020.
La compañía ha querido mostrar la importancia de la autorización lograda para este producto. En este sentido, la responsable global de Biofarmacéuticas de Sandoz, Carol Lynch, ha asegurado que “la inmunología es prioritaria para nosotros y la aprobación de hoy de Erelzi, la segunda en esta área terapéutica en varias semanas, demuestra claramente nuestro compromiso con los pacientes. Esto también puede verse en los avances que estamos haciendo en nuestra cartera de inmunología, con dos aceptaciones recientes en Europa”.
La aprobación de la Comisión Europea se basó en un programa de desarrollo integral que generó datos analíticos, preclínicos y clínicos, así como farmacocinéticos. El programa demostró que Erelzi coincide con su medicamento de referencia en términos de seguridad, eficacia y calidad, explicó Sandoz en un comunicado.
Cabe destacar que Erelzi ha sido autorizado para las mismas indicaciones que su medicamento de referencia (Enbrel, de Pfizer): artritis reumatoide, espondiloartritis axial, psoriasis en placas y artritis psoriásica, entre otras patologías de origen inflamatorio.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 