La Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (Aelmhu) ha presentado datos de acceso en España a los medicamentos huérfanos autorizados por la Agencia Europea del Medicamento (EMA), basándose para ello en el estudio comparativo de los medicamentos autorizados por la EMA con designación huérfana vigente y su autorización y comercialización en España.
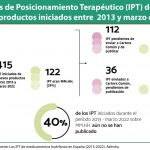
Aelmhu asegura solo un 54% de los medicamentos huérfanos con autorización de comercialización en la Unión Europea, que a fecha del análisis mantenían la designación de huérfano, son comercializados finalmente en España, es decir, 58 de 108. Además, el tiempo transcurrido desde la asignación de Código Nacional hasta la comercialización efectiva habría empeorado en 3,8 meses más (media) y 3,5 meses más (mediana), en comparación con el dato de 2018. No obstante, a fecha septiembre de 2019 se han comercializado más medicamentos huérfanos (10) que en todo el año 2018 (8).
Detectan además diferencias entre medicamentos oncológicos y no oncológicos. Y es que, el 29% de los medicamentos huérfanos autorizados en Europa son oncológicos, mientras que en España suponen el 38% de los medicamentos comercializados. "El tiempo que transcurre entre la obtención del Código Nacional y la comercialización es ligeramente superior para los medicamentos huérfanos no oncológicos, aunque no supone una variación significativa", añaden.
La directora ejecutiva de Aelmhu, Rosabel Arce, justifica la difusión de esta información con su apuesta por "facilitar toda la información posible con respecto a la situación de acceso a los medicamentos huérfanos en España, con el objetivo de lograr un mejor conocimiento sobre el contexto de las enfermedades raras y sus tratamientos en nuestro país". "También la hemos compartido con los actores implicados en la materia", añade.


















 Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados: