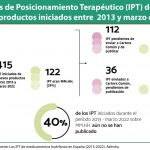
La Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (Aelmhu) ha hecho balance, con motivo del Día Mundial de las Enfermedades Raras, de los procesos de aprobación y comercialización de los medicamentos huérfanos en la Unión Europea y España durante 2019 y ha concluido que el tiempo de acceso a los medicamentos huérfanos se ha incrementado en relación al año 2018, situándose en los 15 meses, frente a unos 12 en 2018. Por este motivo, llaman "a la agilización de los procesos de autorización".
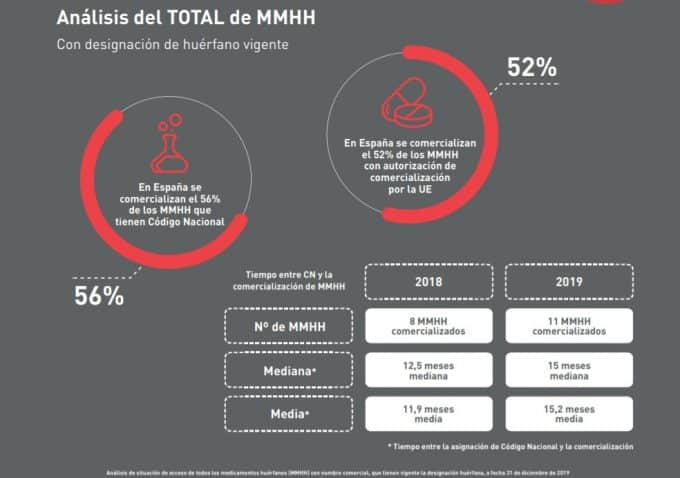
Según Aelmhu, de los 103 medicamentos huérfanos aprobados por la EMA en 2019, 53 (51,5%) lograron ser comercializados en nuestro país. El porcentaje llega al 56% cuando se compara con el número de medicamentos que solicitan código nacional.
Para solventar esta cuestión, Aelmhu propone la implementación de "un modelo de financiación sostenible, que recoja los criterios específicos a la hora de evaluar los medicamentos huérfanos", pero sobre todo que sea "rápido, permitiendo así que los pacientes accedan a estas terapias lo antes posible".
Recuerdan además que, una vez alcanzado el precio y reembolso a nivel nacional, los medicamentos huérfanos "han de pasar por nuevos procesos de aprobación entre las comunidades autónomas, lo que hace que los pacientes tengan que sufrir retrasos adicionales en el acceso al medicamento".
En este sentido, la asociación reitera "la necesidad de que los procesos de aprobación de acceso a los tratamientos con medicamentos huérfanos sean homogéneos en todo el territorio nacional, con independencia de la comunidad autónoma, y además se aumente el número de medicamentos huérfanos a disposición de pacientes en nuestro país".
Aurora Berra, presidenta de Aelmhu, ha mostrado el deseo del sector de que "estas cifras hagan de 2020 un punto de inflexión para la mejora de las condiciones de las personas afectadas por enfermedades raras y la accesibilidad a sus tratamientos". Para ello, se ofrecen "a participar, en conjunto con la Administración, en el desarrollo de políticas públicas, y a colaborar con los agentes implicados en enfermedades raras a nivel político para contribuir mejorar la situación de los medicamentos huérfanos en España".

















 Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.: