La Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (Aelmhu) ha presentado su Informe Anual de Acceso a los Medicamentos Huérfanos en España, un estudio que confirma que 2022 “fue un año muy esperanzador para los pacientes con enfermedades raras (EE.RR.) a nivel europeo, mientras en España siguen aumentando los retrasos en la aprobación de estos tratamientos”.
Ante la próxima conmemoración del Día Mundial de las Enfermedades Raras, Aelmhu hace una valoración de sus indicadores de acceso, advirtiendo que “estamos ante un curso decisivo para la industria farmacéutica en nuestro país”, ya que están previstos proyectos importantes como la nueva Ley de Garantías y Uso Racional de los Medicamentos, el nuevo Reglamento Europeo de MM.HH., la nueva Estrategia Farmacéutica para Europa, el Plan Estratégico de la Industria Farmacéutica 2023-2025 o la presidencia española del Consejo de la UE.
Aelmhu plantea una propuesta alternativa de modelo para los MM.HH., con recomendaciones que ya se han dado a conocer al Ministerio de Sanidad, y que abordan aspectos variados: Desde el reconocimiento del valor económico y social que aporta la investigación sobre nuevos productos e indicaciones, la equidad en el acceso a los tratamientos, la agilización de procesos burocráticos, la mejora del proceso de evaluación, los nuevos modelos de financiación, etc. Y, sobre todo, que se dirigen a dotar de mayor certidumbre, transparencia y participación a todo el trámite de aprobación de los MM.HH. en España.
En palabras de la presidenta de la Asociación, María José Sánchez Losada, “esta iniciativa es más oportuna que nunca, en un momento en el que el diálogo y la colaboración entre el Ministerio de Sanidad y la industria han mejorado”, ya que “la innovación es un activo tangible para los pacientes y la sociedad, pero también un proyecto de futuro y de país. Por eso, planteamos una completa batería de recomendaciones, para urgir a todos los agentes implicados a un cambio de modelo, ya que miles de pacientes y familias nos están esperando”.
A partir de los datos recabados a lo largo del pasado año, AELMHU quiere invitar al debate público de sus propuestas y convoca a todos los agentes implicados -industria, pacientes, comunidad científica, profesionales, decisores públicos y a toda la sociedad- a un gran pacto colectivo con el fin de buscar consensos alrededor de las soluciones que de verdad mejoran la calidad de vida de todas las personas y familias que padecen una enfermedad minoritaria y miran a la investigación con total esperanza.
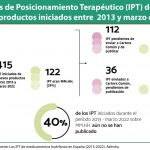
Esta nueva iniciativa se enmarca dentro del Resumen Ejecutivo del Informe de Acceso Anual 2022, un análisis de indicadores que la Asociación realiza desde hace ya 7 años y cuyos resultados preliminares se dieron a conocer hace solo unas semanas. Como novedad, este año el estudio también profundiza en el examen de algunos aspectos relevantes, como aquellos tratamientos huérfanos que cuentan con autorización de comercialización comunitaria pero todavía no disponen de Código Nacional en nuestro país, revisando los plazos y las áreas terapéuticas con las que se corresponden.
Entre las principales conclusiones del documento destacan que la UE alcanzó en 2022 máximos históricos tanto en nuevas designaciones huérfanas de productos con nombre comercial (29) como en nuevas autorizaciones de comercialización (24), lo que ha elevado la cifra de productos con designación huérfana positiva a 195, y a 146 los autorizados.
Sin embargo, a 31 de diciembre de 2022, España contaba con 123 MM.HH. con Código Nacional y 63 financiados, lo que significa que 60 productos huérfanos siguen pendientes de financiación en nuestro país, 5 más que en 2021, cerca de la mitad (45%) de los cuales lleva más de 3 años esperando su incorporación al SNS.
Por otro lado, el tiempo medio de espera para lograr una decisión de precio y reembolso, en el caso de los 9 medicamentos huérfanos que sí fueron financiados, se elevó hasta los 34 meses, 10 meses más de media que el año pasado, lo que podría estar alejando la llegada de la innovación a nuestro país, como demuestran los 23 MM.HH. con autorización comunitaria que, según este informe, todavía no habrían llegado al mercado español.



















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 