La Asociación Española de Laboratorios de Medicamentos Huérfanos y Ultrahuérfanos (AELMHU) ha divulgado su segundo informe Cuatrimestral de Acceso de los Medicamentos Huérfanos en España, utilizando datos actualizados hasta el 31 de agosto de ese año. El informe se enfoca en cuatro indicadores principales para analizar la disponibilidad de estos medicamentos esenciales.
De acuerdo con los hallazgos del informe, de los 148 medicamentos huérfanos que han recibido autorización de la Agencia Europea del Medicamento (EMA), 126 han sido introducidos en España, y 77 están siendo financiados por el Sistema Nacional de Salud (SNS).
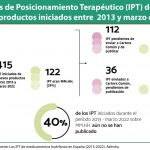
En el segundo cuatrimestre del año, se asignaron dos nuevos Códigos Nacionales, y nueve medicamentos huérfanos recibieron aprobación para financiamiento. Todos ellos se aprobaron con condiciones específicas, y el 78% se autorizó de manera restringida.
Hasta la fecha, el 85% de los medicamentos huérfanos autorizados en la UE han llegado a España. Sin embargo, solo el 52% de ellos están financiados. Cabe señalar que el 49% de estos medicamentos financiados están sujetos a restricciones, como la limitación de indicaciones o indicaciones no financiadas.
Uno de los aspectos cruciales destacados en el informe es el tiempo de espera para la financiación. Tomando como ejemplo los productos aprobados en 2023, el tiempo medio desde que obtienen el Código Nacional hasta que se incluyen en el Nomenclátor es de 26 meses.
Aunque ha habido un aumento significativo en el número de medicamentos huérfanos financiados en los últimos meses, aún existen 49 medicamentos con Código Nacional que no están financiados en España.
El informe también señala una creciente presencia de terapias avanzadas para enfermedades raras con designación huérfana. A pesar de esta tendencia, el número de terapias avanzadas con precio y reembolso en España se ha mantenido constante. Al concluir el informe, de las 15 terapias avanzadas autorizadas para enfermedades raras, 14 están disponibles en España, y solo cinco están financiadas por el SNS.
La información para este informe fue recopilada de fuentes confiables, incluyendo la Agencia Europea de Medicamentos (EMA), el Registro Comunitario de Medicamentos Huérfanos, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y el Ministerio de Sanidad.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: