Las nuevas (o emergentes) compañías biofarmacéuticas, definidas como las que tienen ventas por debajo de los 500 millones de dólares anuales y un gasto en I+D por debajo de los 200 millones, están llevando a cabo el desarrollo de 4.000 potenciales nuevos fármacos. Por sí solas, tienen en sus manos el 65% del total de nuevas terapias en estudio. Un 7% adicional lo desarrollan de la mano de grandes firma, según el informe 'La contribución de las biofarmacéuticas emergentes a la innovación', de IQVIA.
En 2016, estas nuevas compañías, (EBP en la nomenclatura del informe) tenían menos de la mitad de nuevas moléculas en desarrollo, en 2001 solamente el 31%.
Las que están afincadas en China representan el 17% de todos los fármacos en desarrollo, cuando hace cinco años solo llegaban al 6%. El 20% corresponde a moléculas desarrolladas por EBP europeas, y el 46% tiene su central en Estados Unidos, pero estas dos últimas han perdido representación respecto a años anteriores.
Los autores de este documento indican que tener en cuenta la contribución de las EBP a la cartera de investigación (pipeline) de su región o país es una forma de evaluar la madurez del ecosistema innovador por áreas geográficas. En su análisis determinan un rango del 22% en Japón -el más bajo-, 47% en Europa, 62% en Estados Unidos y 83% en China.
El 39% de los medicamentos oncológicos en desarrollo pertenecen a EBP (1.500 productos en total). Hay más de 600 compañías de este tipo centradas exclusivamente en nuevas terapias contra el cáncer, incluyendo muchas que solamente cuentan con un medicamento.
De hecho, por áreas terapéuticas, la oncología es el foco de la mayor parte de las ‘biotech’. Le siguen enfermedades infecciosas y vacunas, y hay menor actividad en neurología e inmunología.
Más pequeñas y ágiles
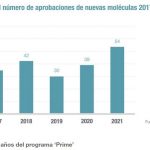
Las EBP han duplicado los ensayos clínicos en los últimos cinco años, y sus tasas de éxito son superiores a las de sus ‘hermanas mayores’, de acuerdo con este estudio. También han incrementado los expedientes de aprobación presentados ante las autoridades regulatorias de forma independiente. En la agencia estadounidense del medicamento, la FDA, han cuadriplicado los expedientes en la última década, y ya tienen el 42% de los productos evaluados por este regulador.
Este tipo de compañía ha financiado más de 3.300 estudios iniciados en 2021, casi el doble que en 2016.
Además, las EBP parecen haberse puesto al día con agilidad a la hora de competir con las grandes compañías, reza el informe. “En total, los fármacos originados en EBP o comercializados por ellas tienen más probabilidades de conseguir alguna forma de evaluación acelerada, lo cual facilita un acceso más rápido al mercado.
Aunque la reducción de los tiempos del desarrollo al lanzamiento es algo que comparten compañías grandes y EBP, la duración de los ensayos clínicos de estas últimas está un año por debajo en tiempo consumido, sobre todo en los campos de la oncología y las enfermedades raras.
Los autores también destacan que el diseño de los ensayos es más flexible y más propenso a la adopción de nuevos esquemas bajo la batuta de las EBP. Los estudios en remoto, virtuales o descentralizados aumentaron de forma acusada en el año 2018, pero también lo hicieron los estudios adaptativos de los modelos ‘basket’ y ‘umbrella’. Esta tendencia es particularmente acusada entre las EBP (más del doble que en las compañías de mayor envergadura).















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: