El panorama sobre la realización de ensayos clínicos dentro del continente europeo no presenta actualmente un panorama muy halagüeño para la industria europea. Así lo ha señalado un nuevo informe de la Efpia en el que revela que una caída en del 22 al 12% en la cuota de estudios clínicos de la UE durante la última década. España parece, en el informe realizado por IQVIA y Vaccines Europe, de los pocos países que se salva de esta visión general. La Efpia califica a España de “caso de éxito” y lo coloca como país que más ensayos realiza en el continente.
La Efpia ve en esta situación un responsable claro: “Los ensayos clínicos europeos se ven obstaculizados por un ecosistema de investigación lento y fragmentado; las actuales iniciativas son insuficientes para detener y revertir una década de declive”, asegura Nathlaie Moll, directora general de Efpia. “Para que Europa sea competitiva debe funcionar como una región unificada y no como Estados Miembros individuales, y estar respaldada por políticas que atraigan inversiones. Sólo entonces los europeos podrán disfrutar de las mismas oportunidades de acceso a avances médicos que otras partes del mundo”, asegura.
En suma, desde la asociación europea demandan claramente “una evaluación urgente del Reglamento de Ensayos Clínicos y la adopción de medidas que armonicen y simplifiquen el panorama de ensayos clínicos en toda la UE, para facilitar los ensayos clínicos multinacionales”.
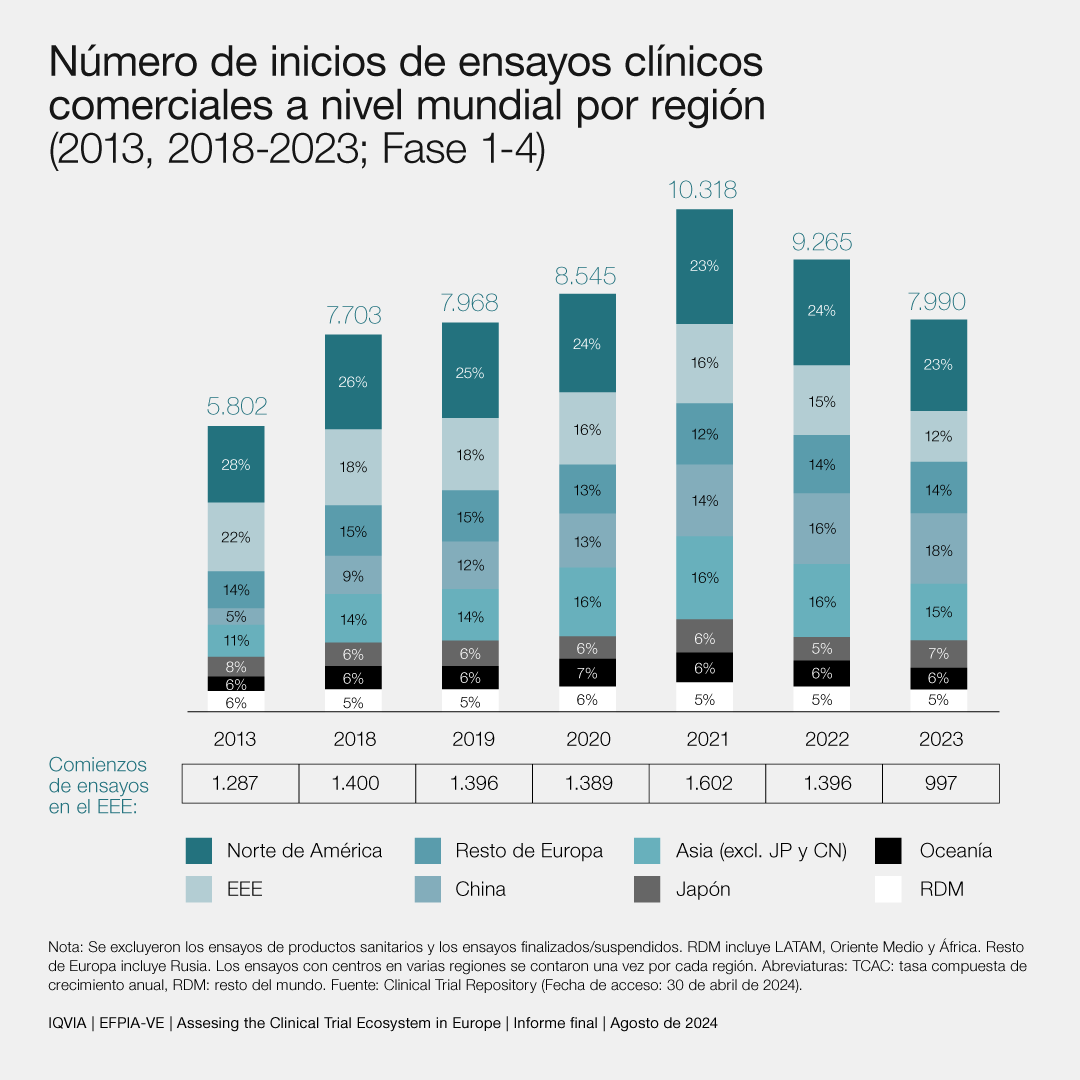
El descenso porcentual europeo indica que entre 2013 y 2023, indica que “60.000 pacientes europeos han perdido la oportunidad de acceder a nuevos medicamentos en fase experimental entre 2018 y 2023”.
Y mientras tanto, en el mismo período en que Europa perdía competitividad, China ha multiplicado el número de ensayos, pasando del 5 al 18% del total. Estados Unidos ha bajado del 28 al 23% y Asia (sin contar China y Japón) ha pasado del 11 al 15%.
En el caso de la oncología, los ensayos en Europa han ido disminuyendo desde 2018, debido a factores de complejidad regulatoria y también de carácter científico. Para contribuir a frenar la caída, Europa pone el foco en iniciativas como la Misión Cáncer y el Plan Europeo contra el Cáncer de la UE.
En cuanto a investigación clínica en inmunización, los datos muestran que los ensayos han caído de forma muy importante desde el 17% de cuota al 8% entre 2018 y 2023. En enfermedades raras, aunque los ensayos aumentan a nivel global, en estas patologías cae un 4%. Para las terapias celulares y génicas, la cuota ha descendido del 25 al 10% entre 2013 y 2023. En el mismo período China ha pasado del 10 al 42%, gracias a un entorno regulatorio favorable, financiación y un enfoque estratégico para las terapias avanzadas.
El documento advierte del declive de los ensayos en pediatría, que han caído un 7% desde 2018, mientras aumentaban un 4% a nivel global. Por último, se detiene en los ensayos en fase 1, por su importancia como base para el desarrollo clínico posterior, la inversión y financiación.
España
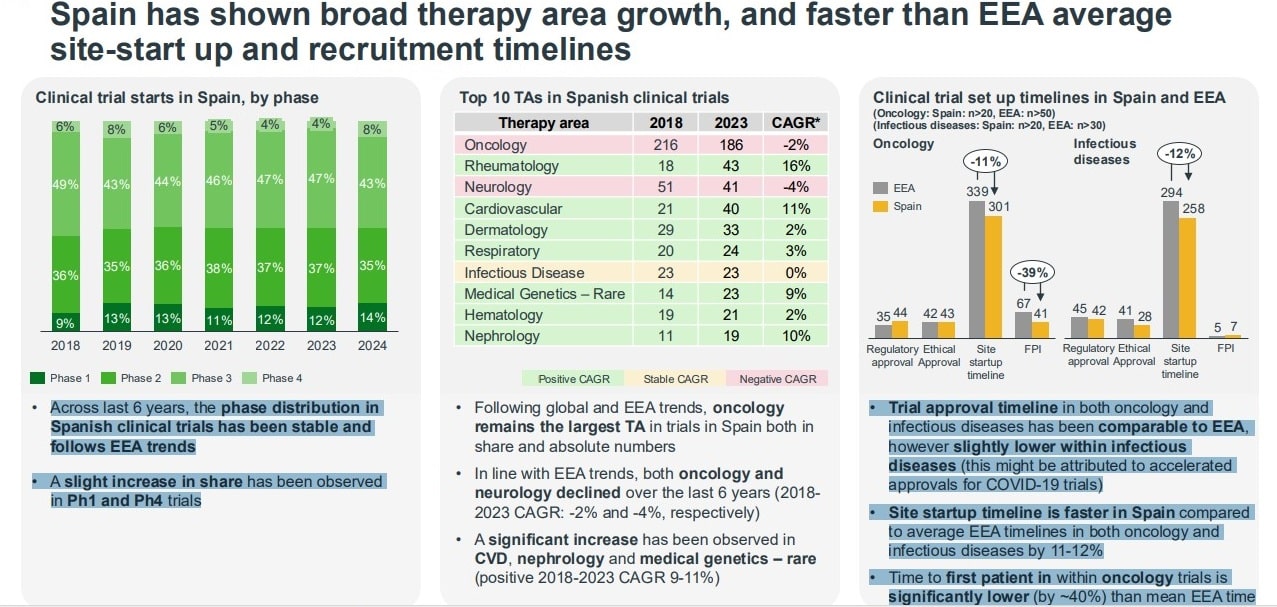
En este contexto de pérdida de competitividad y disminución de la actividad en investigación clínica, el informe presenta a España como “un caso de éxito”, al alcanzar la primera posición por número de ensayos iniciados en 2023.
El éxito español “se debe principalmente a la implementación de la regulación de ensayos clínicos (CTR) europea, que España fue la primera en adoptar desde 2016”. No en vano, la inversión en esta área ha crecido a un ritmo del 5,7% anual desde 479 millones en 2012 a 834 millones en 2022.
El informe destaca que España ha adoptado un enfoque proactivo, coordinado y trasversal para construir su ecosistema de ensayos clínicos, impulsado por el aumento de la inversión. Entre los factores que atraen dichas inversiones, el documento incide en cinco: La calidad del sistema de salud de España, por ejemplo, la infraestructura hospitalaria; la exitosa implementación de nueva legislación europea sobre ensayos clínicos y la adaptación de su propia legislación en consecuencia; un modelo de colaboración efectivo entre ensayos clínicos promovidos por la industria y públicos; la ubicación de centros de investigación clave en varias ciudades importantes, con –en general- más de tres centros de investigación por cada 10.000 km cuadrados en el país y finalmente, en cuanto a inmunización, excluyendo los años de la pandemia de COVID-19, se inician aproximadamente 20 ensayos al año en España.

Línea de trabajo
Si bien España ha conseguido posicionarse como un líder en ensayos clínicos, la industria farmacéutica innovadora dispone de unas líneas de trabajo para consolidar y reforzar ese liderazgo, para contribuir a recuperar la competitividad europea.
Una de ellas es la agilización y reducción de procesos de gestión en investigación clínica, con la implementación de proceso de fast track para ensayos de fase 1; la reducción, simplificación y agilización de burocracia en los procesos o los ensayos combinados con diagnóstico in vitro.
Otra de las estrategias es el fomento de la investigación clínica en Atención Primaria, con una guía de recomendaciones propuesta por Farmaindustria que se está acercando a las comunidades autónomas, o la promoción de ensayos clínicos descentralizados y en red. El uso de datos en vida real, el fomento de la diversidad en los estudios o la difusión de una guía de excelencia para la realización de EECC en Farmacia Hospitalaria son otras de las líneas de trabajo a corto y medio plazo.
“Los desafíos para mantener la competitividad y reforzar el liderazgo en España son cada vez mayores y por ello debemos seguir trabajando de forma flexible y colaborativa, anticipándonos a los cambios y con un entorno que nos permita desarrollar la innovación de nuestras compañías”, afirma la directora de Investigación Clínica y Traslacional de Farmaindustria, Amelia Martín Uranga.
Reforma
El informe utiliza cifras del Reino Unido para extrapolarlas a la UE y cifra entre 1.000 y 1.500 millones de euros los beneficios para los sistemas por los pagos por ensayos clínicos y ahorros en costes de medicamentos.
Por todo ello, los autores del informe piden que se aborde la pérdida de competitividad con urgencia, con implicación de todas las partes e implementación de políticas públicas que tengan en cuenta la importancia de los incentivos regulatorios a la innovación, tal y como recoge el informe Draghi. En ello incluyen una evaluación urgente del Reglamento de Ensayos Clínicos y la adopción de medidas que armonicen y simplifiquen el panorama de ensayos clínicos en toda la UE, para facilitar los ensayos clínicos multinacionales. Además, abogan por ampliar la capacidad para ensayos, mejorar las infraestructuras y “emular el desempeño de España”.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: