A pocas semanas de que, previsiblemente, se apruebe por el Consejo de Ministros el Real Decreto de Evaluación de Tecnologías Sanitarias, ya se empiezan a conocer algunos detalles acerca de los cambios introducidos tras el periodo de alegaciones al que se sometió el proyecto de real decreto entre agosto y septiembre pasados.
Uno de los cambios más relevantes se encuentra en el anteriormente denominado grupo de posicionamiento. Según ha podido saber Diariofarma, el grupo que desarrollará las funciones de análisis de los informes elaborados por las Oficinas de Evaluación y realizará una valoración final de los mismos se denominará Grupo de Adopción.
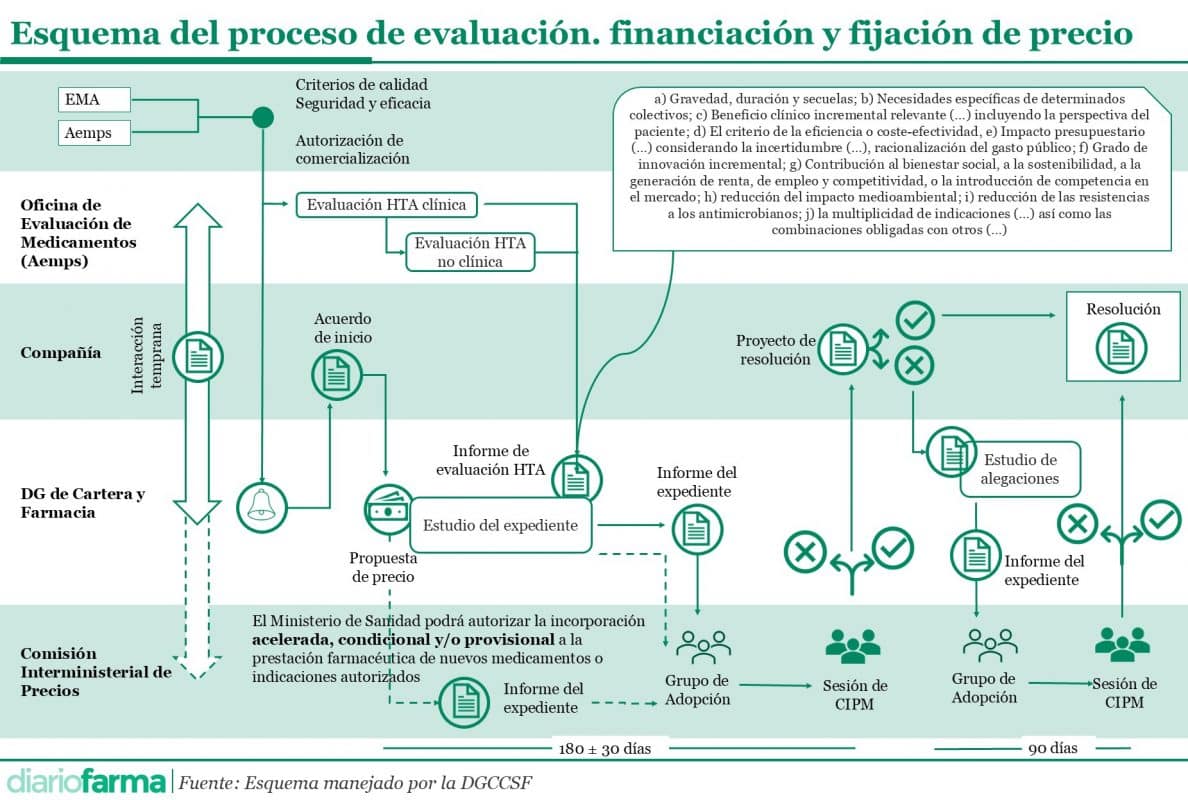
En relación con este grupo, además, había una falta de claridad en cuanto a su funcionamiento y dependencias. El borrador de esta regulación lo situaba en el ámbito de la evaluación, pero desde el sector se consideraba que estaba más cerca del ámbito de decisión y, por tanto, debía ser regulado por el futuro Real Decreto de Precio y Financiación de Medicamentos. Diariofarma ha accedido a un esquema que está siendo manejado por la Dirección General de Cartera Común de Servicios del SNS y Farmacia (DGCCSF), y la ubicación de este Grupo de Adopción es próxima a la Comisión Interministerial de Precios de los Medicamentos (CIPM). De este modo, parece que se confirma lo que el director general, César Hernández, había planteado en relación con que este grupo fuera una “bisagra” entre los sistemas de evaluación y la decisión.
El esquema de todo el proceso recoge claramente la duración del expediente desde que existe una propuesta de precio: 180 días, que podrán variar en 30 días más o menos para cuadrar con la fecha de celebración de la CIPM. En ese periodo se deberá realizar la evaluación no clínica por parte de las Oficinas de Evaluación, así como el estudio del expediente a nivel de la DGCCSF, el análisis por parte del Grupo de Adopción y pasar finalmente por una CIPM.
Igualmente, el esquema recoge los criterios de financiación que se establecían en el borrador filtrado de la Ley de los Medicamentos, que añade a los existentes en la actualidad, la contribución al bienestar social, sostenibilidad o generación de renta; el impacto ambiental o la reducción de resistencias a los antimicrobianos, entre otras situaciones, como la multiplicidad de indicaciones o las combinaciones obligadas con otros.
Además, en el procedimiento se prevé tanto una interacción temprana entre el laboratorio y la DGCCSF, así como una vía acelerada, condicional o provisional que puede saltarse la fase de estudio del expediente y el informe de evaluación de HTA emitido por las oficinas.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 