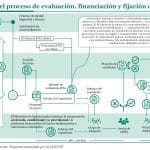
El Grupo de Posicionamiento, recogido en el proyecto de Real Decreto de Evaluación de Tecnologías Sanitarias, está más cercano a ser un comité preparatorio de la Comisión Interministerial de Precios de los Medicamentos (CIPM) que al resto del sistema de evaluación diseñado. Tanto es así que el propio director general de Cartera Común de Servicios del SNS y Farmacia, César Hernández, planteó la posibilidad de utilizarlo como un elemento bisagra “a caballo” entre los procesos de evaluación y decisión, aunque reconoció que tendría un mayor peso en este último aspecto.
Hernández, durante su análisis del proyecto de real decreto en una ponencia ofrecida en el XXIII Encuentro de la Industria Farmacéutica Española, celebrado en Santander en el marco de los cursos de verano de la Universidad Internacional Menéndez Pelayo (UIMP), sugirió que en el texto final debería existir una disposición que vincule, a través de este grupo de posicionamiento, la decisión que se regulará en el próximo Real Decreto de Precio y Financiación.
El director general también señaló que el informe de este grupo se elaborará considerando todos los datos: desde los informes de las evaluaciones clínica y no clínica a las propuestas de precio negociado entre el desarrollador de la tecnología y el Ministerio. Por lo tanto, esta negociación entre industria y Ministerio deberá realizarse en paralelo al proceso de posicionamiento.
De este modo, se consolida la idea de que el Grupo de Posicionamiento actúa como un facilitador de las decisiones de la CIPM, a la que recomendará la financiación en función de los informes recibidos. Sin embargo, cabe destacar que las comunidades autónomas tendrán una posición de mayoría en este grupo, a diferencia de lo que ocurre actualmente en la CIPM. Actualmente, las comunidades autónomas tienen tres votos de once en la CIPM, pero en el Grupo de Posicionamiento planteado en el borrador del real decreto tendrían 17 de 27 votos posibles.
Durante el encuentro, profesionales de la industria farmacéutica plantearon si sería el momento adecuado para que la CIPM recupere el espíritu de reparto de competencias establecido en la Constitución de 1978, ya que, de no ser así, la competencia en materia farmacéutica se trasladaría directamente a las comunidades autónomas. Hernández declinó valorar esta posibilidad, asegurando que no es un debate para el real decreto de ETS, aunque subrayó la importancia de “dar cabida” a los intereses de las comunidades autónomas, que “deben tener su papel”.
Hernández también se mostró abierto a la posibilidad de cambiar la denominación del Grupo de Posicionamiento, ya que distintos actores entienden cosas diferentes sobre lo que implica el posicionamiento, y “no queremos dejar reminiscencias de los IPT que ya no van a existir”. Solicitó a los presentes, y extendió la invitación a quienes presenten alegaciones, que hagan propuestas sobre la denominación del grupo, así como otros aspectos que puedan mejorar la redacción final del real decreto.
Más allá de esta cuestión, Hernández analizó los aspectos más relevantes del proyecto de real decreto y recordó que el objetivo de las evaluaciones de tecnología sanitaria es informar las decisiones en el momento en que se requiera, por lo que no se trata de realizar evaluaciones académicas perfectas sino aquellas que sean las necesarias para la decisión.
El director general también enfatizó el compromiso de España con las decisiones e informes que lleguen desde Europa. “Tendremos absoluta coherencia y lealtad con el reglamento europeo y cualquier otro desarrollo legislativo”, explicó.
Uno de los elementos clave del proyecto de real decreto es que gran parte de las definiciones del sistema de evaluación se basarán en el documento definido en el artículo 22, que servirá de guía para todo el proceso. Hernández justificó esta decisión debido a la dificultad de revisar leyes y reales decretos, lo que ralentizaría la actualización necesaria para responder a las demandas de un sector “muy cambiante y difícil de prever”, como el farmacéutico. Por ello, el modelo seguido es similar al planteado en la normativa de ensayos clínicos, con documentos y guías “vivas” que puedan actualizarse fácilmente, ya que este sistema no será “el de los próximos 100 años, sino que debe evolucionar”. Aunque Hernández no lo mencionó, la parte negativa de este modelo es la posible indefensión o falta de seguridad jurídica que algunos operadores del sistema podrían sufrir, tal y como lamentan fuentes de la industria.
Ley de Garantías y RD de precios
Hernández también explicó otros aspectos relacionados con la modificación de la Ley de Garantías y el próximo RD de precios. En cuanto a la Ley de Garantías, señaló que “en un plazo no muy largo” se espera que pase por el Consejo de Ministros en su primera vuelta, mientras que para el real decreto de precios se prevé una consulta pública previa para este mismo año. Estas optimistas previsiones también se extendieron al RD de ETS, que el director general espera que pueda publicarse en 2024.
En cuanto al real decreto de precios, se espera que se desarrolle a lo largo de 2025, y Hernández, consideró que no sería necesario esperar a la aprobación de la Ley de Garantías para que este RD tuviera el soporte legislativo necesario. Según él, “gran parte de las demandas en materia del real decreto de precios, se pueden desarrollar de forma compatible con la ley vigente”.

















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 