
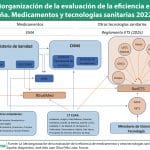
Ya se cerró el plazo para remitir alegaciones al borrador del Real Decreto de Evaluación de Tecnologías Sanitarias (ETS), y parece que el Ministerio de Sanidad, especialmente la Dirección General de Cartera Común de Servicios del SNS y Farmacia (DGCSF), tendrá mucho trabajo. Hace unos días, el director general César Hernández explicó que había muchas alegaciones y que en los últimos días estaban creciendo de forma exponencial.
A la vista de lo comentado recientemente en diversos encuentros del sector, así como por el acceso que Diariofarma ha tenido al documento de alegaciones presentado por Farmaindustria, parece que hay muchas cuestiones, algunas de ellas de entidad, que se solicitan al Ministerio de Sanidad. El objetivo es alcanzar unas garantías mínimas de seguridad jurídica, de acuerdo con la legislación administrativa, y evitar caer en algunos de los errores que la Audiencia Nacional achacó a Revalmed, lo que supuso su anulación.
Es positivo saber, como ha podido confirmar este periódico, que desde Sanidad se está considerando aceptar algunos cambios relacionados con lo mencionado anteriormente, al menos en cuanto a ganar seguridad jurídica. De este modo, se podría aceptar que todos los documentos que vayan a suponer una obligación para alguien tengan el rango normativo suficiente y se publiquen en el Boletín Oficial del Estado (BOE), en lugar de en la página web del Ministerio. Sin embargo, persisten discrepancias significativas, especialmente en torno a la consideración de la evaluación como un procedimiento administrativo independiente tras la separación de los procedimientos de evaluación y de precio y financiación.
Juristas, como se vio en el III Congreso de Derecho Farmacéutico organizado por el Colegio de Abogados de Madrid (ICAM), y Farmaindustria lo ven muy claro. No obstante, desde Sanidad no parece que estén de acuerdo con esta cuestión a día de hoy. Fuentes de este departamento, liderado por Mónica García, aseguran que los únicos procedimientos administrativos son el de autorización y el de fijación de precio y financiación, y consideran al proceso de evaluación que regula el RD de ETS como un ‘subproceso’, no un acto administrativo. Por ese motivo, no se estima necesario regular un periodo de audiencia tras la revisión del expediente, de acuerdo con la Ley 39/2015.
La falta de consenso en este punto no es menor. La consideración del proceso de evaluación como un procedimiento administrativo, y por tanto con obligaciones hacia el interesado que ha desarrollado la tecnología sanitaria, parece una cuestión que, si no se resuelve en las alegaciones, tendrá una batalla jurídica con gran probabilidad. Podría incluso ser motivo de anulación de la norma y acumular diversos recursos en cada proceso de evaluación de medicamentos o tecnologías.
Otras alegaciones presentadas por Farmaindustria proponen renombrar algunos órganos e, incluso, al propio sistema. Estas propuestas podrían ser aceptables. En primer lugar, porque la evaluación no es solo de la eficiencia, como sugiere el nombre propuesto en el borrador del RD de ETS para las oficinas y el sistema en general. En segundo lugar, respecto al Grupo de Posicionamiento, se responde a la petición del propio Hernández de buscar un nombre adecuado para este grupo, que en realidad es preparatorio para la decisión de la Comisión Interministerial de Precios de los Medicamentos (CIPM). Propone que se denomine Grupo de Recomendaciones para la inclusión en la prestación. Vale, describe claramente lo que hace, frente a un término, el de posicionamiento, que cada uno entiende de un modo.
Farmaindustria también reclama más participación en órganos como el Consejo de Gobernanza, donde, además de diversos ministerios y comunidades autónomas, participan profesionales y pacientes. Desde Sanidad se ha cuestionado la presencia de representantes de la industria en este Consejo, argumentando que no hay representantes de la administración en los órganos de gobierno de la industria. Aunque es comprensible que se quiera evitar posibles conflictos de interés, asegurar que los desarrolladores de tecnologías tengan canales adecuados de comunicación y puedan aportar comentarios constructivos es beneficioso para el sistema en su conjunto. Por tanto, es necesario asegurar el derecho de audiencia para todos los documentos, guías y metodologías que vayan a regir el sistema de evaluación, lo cual se lograría si se aprueban mediante orden ministerial, así como para todos los informes de evaluación. Sanidad no debería temer escuchar lo que la industria tenga que decir sobre los procedimientos o informes elaborados, ya que su opinión no sería vinculante, pero podría aportar puntos de vista valiosos.
Respecto del resto de propuestas planteadas por Farmaindustria en relación con la composición del Consejo de Gobernanza y, especialmente el Grupo de Recomendaciones para la inclusión en la prestación, creo que es también acertado ya que devuelve al ámbito estatal la competencia reguladora del medicamento, como promulga la Constitución y evita que las comunidades autónomas, por sí solas, dispongan de una mayoría más que absoluta.
La aprobación del Real Decreto de ETS es un hito de gran relevancia que debe abordarse con la mayor diligencia y cuidado. Es fundamental que se establezca un marco legal sólido y consensuado, que evite futuros litigios y permita asegurar la eficiencia y equidad en la evaluación de tecnologías sanitarias, con una perspectiva beneficiosa para los pacientes a corto y largo plazo. Solo de esta manera se podrá garantizar un sistema de salud que responda eficazmente a los desafíos actuales y futuros, promoviendo la innovación y priorizando el bienestar de los pacientes.
José María López Alemany es director de Diariofarma.
 Artículo de opinión de José María López Alemany, director de Diariofarma, sobre la propuesta de Real Decreto de Evaluación de Tecnologías Sanitarias y las alegaciones y cambios que se reclaman por parte del sector.
Artículo de opinión de José María López Alemany, director de Diariofarma, sobre la propuesta de Real Decreto de Evaluación de Tecnologías Sanitarias y las alegaciones y cambios que se reclaman por parte del sector.









 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: