Córdoba acogerá este año la organización del IX Seminario de Farmacovigilancia, la primera reunión de este tipo que se celebra tras el parón causado por la pandemia y que estará orientado a la seguridad de los medicamentos.
Estos seminarios se organizan de forma conjunta entre la Agencia Estatal de Medicamentos y Productos Sanitarios (Aemps) y un Centro Autonómico de Farmacovigilancia y forman parte de las actividades de formación continuada del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), en el que participan todas las comunidades autónomas y del que forma parte el Centro Andaluz de Farmacovigilancia de la Dirección General de Salud Pública y Ordenación Farmacéutica.
La sede será la Sala Mudéjar del Rectorado de la Universidad de Córdoba donde 50 profesionales, responsables de la Farmacovigilancia de toda España se van a encontrar para mejorar las habilidades en detectar riesgos y establecer lazos para buscar soluciones en la detección de reacciones adversas de medicamentos, es decir aquellos efectos no deseados de un medicamento o no esperados.
El lema del Seminario es "Buscando soluciones", y tiene el objetivo de realizar una reflexión sobre las posibles opciones que ayuden a identificar riesgos de los medicamentos. Además, este año se contará con la presencia de Niklas Noren del Uppsala Monitoring Centre, donde se gestiona el Programa Internacional de Monitorización de Medicamentos de la Organización Mundial de la Salud.
Estas actividades repercutirán en el futuro en disponer de medicamentos más seguros. Un compromiso por la seguridad sanitaria en el que participan profesionales sanitarios, industria farmacéutica y ciudadanía para detectar y comunicar posibles reacciones adversas a los medicamentos.
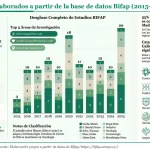
En esta reunión está prevista también la presentación del funcionamiento del Centro Andaluz de Farmacovigilancia de Andalucía, así como diversos aspectos relacionados con la base de datos FEDRA (Farmacovigilancia Española, Datos de Reacciones Adversas), que contiene las notificaciones de sospechas de reacciones adversas a medicamentos (RAM) de uso humano, así como de los acontecimientos adversos ocurridos después de la vacunación.
En cada comunidad autónoma existe un centro de farmacovigilancia, encargado de registrar en Fedra las notificaciones de efectos adversos que se sospecha que pueden ser debidos al medicamento. Los datos de las notificaciones son validados y registrados en la base de datos FEDRA, utilizando estándares internacionales y criterios previamente establecidos. Los datos del paciente y del notificador están anonimizados en FEDRA para mantener la confidencialidad. Los Centros de Farmacovigilancia conforman el Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano (SEFV-H), junto con la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), que coordina dicho sistema.
El principal objetivo de la notificación espontánea de sospechas de Reacciones Adversas a Medicamentos (RAM) es establecer un sistema ágil y rápido de identificación de potenciales RAM no identificadas previamente, a través del análisis de la base de datos FEDRA, lo que en farmacovigilancia se conoce como “generación de señales”, indica la AEMPS. Estas señales de riesgos potenciales siguen investigándose por las agencias de medicamentos, y si se confirma una posible relación con el medicamento, se incluye información en su ficha técnica y prospecto.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: