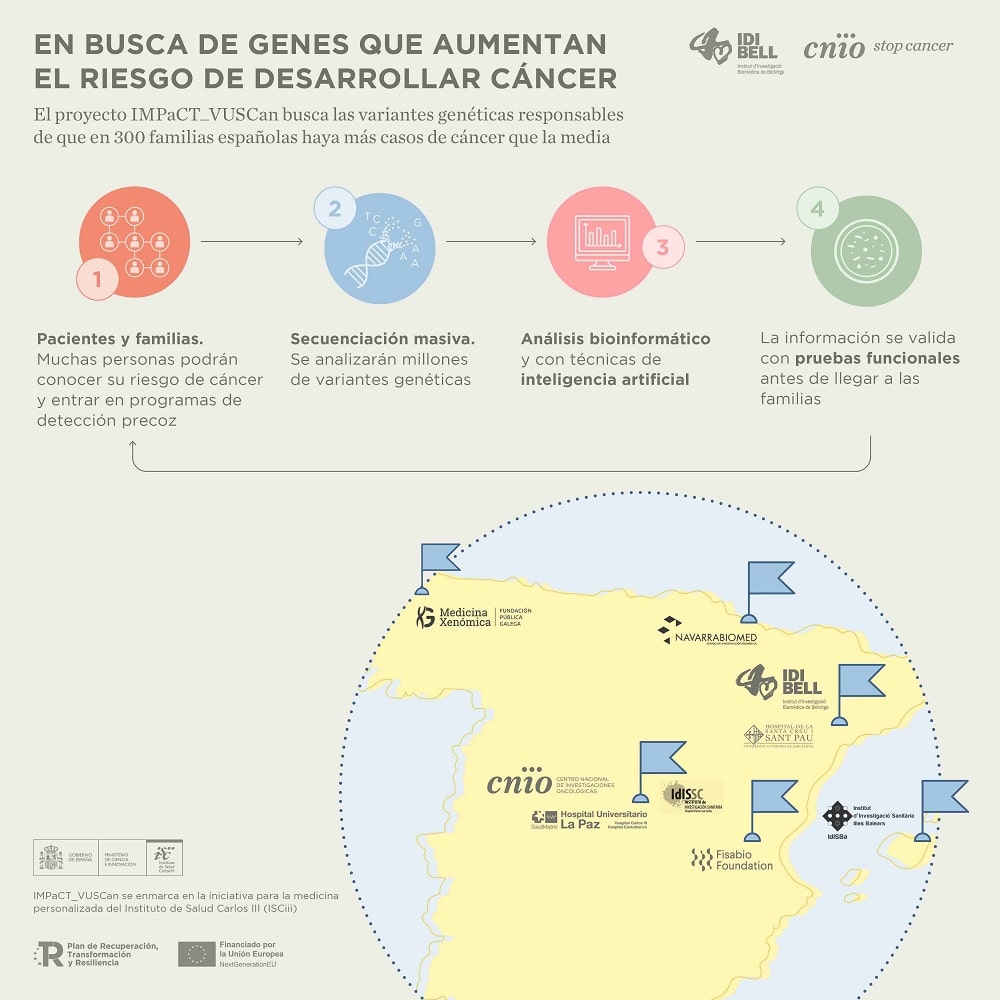
Conocer el riesgo y facilitar así la prevención es el objetivo de IMPaCT_VUSCan, una iniciativa del Centro Nacional de Investigaciones Oncológicas (CNIO) y el Instituto de Investigación Biomédica de Bellvitge/Instituto Catalán de Oncología (Idibiel/ICO) y en el que participan otros siete centros de investigación españoles.
El objetivo es ampliar el conocimiento sobre las variantes genéticas que inciden en la predisposición al cáncer [las variantes vienen a ser las distintas versiones de un gen; puede haber miles de variantes de cada gen]. Según explican desde el CNIO, “los primeros beneficiarios de este proyecto serán familias con genes de alto riesgo que se transmiten de padres a hijos, y en las que por tanto hay más casos de cáncer de lo habitual”. Esta es una de las razones por las que el proyecto recabará y analizará con la máxima profundidad datos de más de trescientas familias de toda España con casos de cáncer familiar.
El proyecto cuenta con 3.179.990 euros de financiación, y se prolongará hasta diciembre de 2025.
“Esperamos mejorar el manejo clínico de los miembros de las familias con cáncer hereditario”, afirma Mercedes Robledo, jefa del Grupo de Cáncer Endocrino Hereditario del CNIO investigadora principal de IMPaCT_VUSCan. “Este proyecto permitirá identificar en los próximos años qué variantes genéticas, de entre las miles que porta cada individuo, están relacionadas con el desarrollo de su cáncer. Eso impulsará la medicina personalizada para todos”.
“Nuestro abordaje está orientado a cáncer familiar, pero la información que obtengamos también será útil para avanzar en la comprensión de genes implicados en el cáncer en general”, añade Robledo.
Las mutaciones con las que se nace y los factores ambientales, como el estilo de vida, determinan la predisposición al cáncer. Algunas personas heredan de sus padres mutaciones o variantes en genes que aumentan el riesgo a desarrollar la enfermedad. Como algunas de estas variantes ya se conocen, hoy en día el Sistema Nacional de Salud español puede detectar y ofrecer seguimiento a quienes las portan, para detectar precozmente la enfermedad y personalizar el tratamiento.
Se hace a través de las consultas de cáncer familiar, y es una estrategia que da resultado. “Las consultas de cáncer familiar ya han conseguido reducir a la mitad la incidencia de cáncer en pacientes que son seguidos en estos programas, y que su esperanza de vida ha aumentado hasta diez años”, declara Conxi Lázaro, investigadora principal del proyecto y jefa del Grupo de Cáncer Hereditario del IDIBELL y el Instituto Catalán de Oncología. “Pero quedan por identificar muchas variantes que influyen en el riesgo a desarrollar cáncer”.
En cáncer de mama, por ejemplo, se han identificado ya una decena de genes de predisposición, y dos de ellos hacen que el riesgo de desarrollarlo sea de hasta un 70%. Pero esta decena de genes solo explican la mitad de los casos de cáncer de mama con componente hereditario, lo que significa que quedan por detectar factores genéticos adicionales relacionadas con la susceptibilidad a este tipo de cáncer.
La incertidumbre
Los investigadores saben que la mayoría de variantes genéticas que identifiquen serán “de significado desconocido”, es decir: “cuando analizamos los genomas de los miembros de las familias afectadas encontramos variantes genéticas para las que no se ha demostrado previamente que tengan un efecto, y por tanto no sabemos si son las responsables del desarrollo de la enfermedad de esa familia”, explica Robledo.
Estas Variantes de Significado Desconocido (VUS por sus siglas en inglés) generan mucha frustración: “Al final lo que queremos es que la información que le llegue a un médico sea útil, que ayude a decidir si es una variante es importante o no. Precisamente por esta razón cobra sentido el Proyecto IMPaCT_VUSCan”, dice Robledo.
“Muchas de las nuevas variantes observadas no suelen tener pruebas suficientes para ser consideradas como patogénicas o benignas, y finalmente se clasifican como VUS”, explican los investigadores en el proyecto. “Una VUS puede ser confusa para pacientes y médicos porque crea incertidumbre, y no puede utilizarse para orientar el diagnóstico o el tratamiento”.
Inteligencia Artificial
Por eso acaba de empezar este año IMPaCT VUS_Can, en el que la investigación se focaliza justamente en las Variantes de Significado Desconocido, y se analizan 300 familias. El objetivo es avanzar hacia “resolver las VUS”, es decir, esclarecer su papel en la predisposición al cáncer.
Dada la gran cantidad de VUS previsiblemente identificadas en el genoma de un individuo, el primer paso será establecer prioridades. Esa es la labor de los grupos de bioinformática, que analizan las cantidades ingentes de información genómica y desarrollan métodos de Inteligencia Artificial para identificar las variantes más importantes. Sus predicciones deberán ser validadas con ensayos funcionales.
A medida que se vayan resolviendo variantes, se incluirán en las bases de datos de variantes genéticas, que en última instancia servirán para mejorar la precisión y personalización de los diagnósticos y tratamientos oncológicos.
Además de CNIO e Idibiell, IMPaCT_VUSCan cuenta con la participación de siete centros de investigación en toda España, como son el Instituto de Investigación Sanitaria Sant Pau (IIB Sant Pau), el Instituto de Investigación Sanitaria de Navarra (IdiSNA), el Instituto de Investigación Sanitaria Hospital Clínico San Carlos (IdISSC), la Fundación Pública Galega de Medicina Xenómica (FPGMX), la Fundación para el Fomento de la Investigación Sanitaria y Biomédica de la Comunitat Valenciana (Fisabio), la Fundación Instituto Investigación Sanitaria Islas Baleares (IDISBA) y el Instituto de Investigación Sanitaria La Paz (IdiPaz).
Medicina personalizada
El ISCIII desarrolla desde 2020 la Infraestructura de Medicina Personalizada IMPaCT, con tres ejes Medicina Predictiva, Medicina Genómica y Ciencia de Datos que, de forma individual o en su conjunto dentro de IMPaCT, están diseñados para prestar servicio al sistema de I+D+I con orientación a la Medicina de Precisión.
IMPaCT-GENóMICA es una infraestructura cooperativa distribuida en nodos para estudios genéticos de alta complejidad basados en tecnologías del ámbito de la investigación, uno de los cuales es IMPaCT-VUSCan, financiado por el ISCIII, dentro de las convocatorias anuales de financiación de proyectos asociados a IMPaCT.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 