Los medicamentos incluidos en el programa Priority Medicines (Prime) de la Agencia Europea de Medicamentos (EMA) tardan una media de 715 días en conseguir una decisión de precio-reembolso en nuestro país. Esta cifra supone 86 días más que la media de los medicamentos autorizados en nuestro país que, según el estudio WAIT de IQVIA, llega a los 629 días.
Prime es un sistema que incluye dos elementos principales. Por un lado, una asesoría científica por parte de la EMA para el desarrollo clínico de los medicamentos y, por otro, la aplicación de un procedimiento acelerado de revisión, que reduce en 60 días el proceso habitual de evaluación que se establece en 210 días.
Respecto de los plazos totales, resulta que la suma de los periodos de evaluación, por parte de la EMA, y financiación por parte de las autoridades nacionales de España, son menores en los medicamentos no Prime que en los designados prioritarios por la EMA. En media tardarían 26 días más en estar disponibles los medicamentos designados como Prime. Algo que a todas luces no parece lógico.
Este retraso se debe fundamentalmente a las dudas acerca de la eficacia y seguridad de los medicamentos y a la incertidumbre existente tanto clínica como económica, tal y como han señalado en numerosas ocasiones algunos gestores del sistema sanitario. No obstante, tal y como explica a Diariofarma la directora del Departamento de Acceso de Farmaindustria (FI), Isabel Pineros, la existencia de una asesoría científica por parte de la EMA, debería dotar de mayor fortaleza a los datos obtenidos en los ensayos. “No se pueden cuestionar los ensayos cuando ha habido un asesoramiento por la EMA”, indica.
Pese a ello, en nuestro país se cuestiona la autorización de comercialización y no se aplica a estos medicamentos un procedimiento acelerado. Por ese motivo, Pineros considera que “existe una discrepancia” entre lo que decide la EMA y lo que luego aplican las autoridades nacionales y autonómicas.
Recuperar el pago por resultados
La solución para Pineros estaría en recuperar un mecanismo de control de la financiación que en los últimos tiempos ha caído en desuso, pero que para este tipo de medicamentos sería adecuado. Se trata de los acuerdos de riesgo compartido y pago por resultados. Se trata de un modelo que solo se ha aplicado a cuatro medicamentos (Yescarta, Kymriah, Zolgensma y Polivy), pero que debería aplicarse a muchos más. A este respecto, la representante de Farmaindustria lamenta que “el año pasado no se financiaron medicamentos con pago por resultados, mientras que se ha vuelto a la fórmula tradicional del techo de gasto”.
La razón, según esta experta sería que Valtermed no facilita la toma de los datos y los costes de gestión de los acuerdos de riesgo compartido suponen importantes esfuerzos para las comunidades autónomas. Tal vez por ello, solo cinco de los 27 medicamentos Prime están en Valtermed. A pesar de todo, Pineros considera que, dada la incertidumbre esgrimida por la Administración y los costes de estos medicamentos, junto con el importante impacto sanitario que pueden tener, justificaría la aplicación de acuerdos de riesgo compartido siempre que se acelerara la incorporación de estos medicamentos. “Si hay incertidumbres, hay que utilizar un tipo de acuerdo que permita resolverlas”, reclama Pineros.
Lo que no tiene ningún sentido es que un medicamento prioritario para la EMA sea cuestionado desde el punto de vista clínico en el proceso de financiación y precio nacional. Ejemplo de esto es que, más allá de los retrasos registrados, la mayor parte de los medicamentos Prime tienen restringidas sus indicaciones.
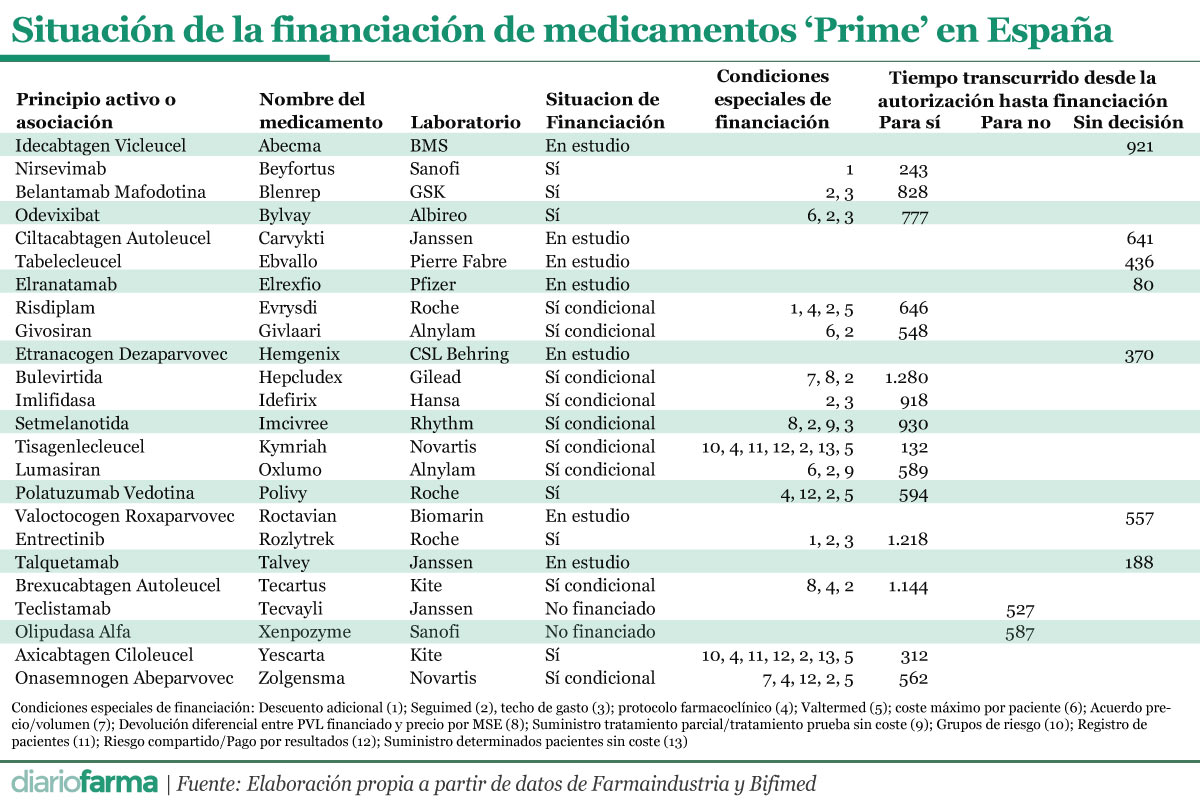
De los 27 medicamentos Prime autorizados, tres no tienen código nacional en España, dos tienen resolución negativa de financiación, 7 están en estudio y 15 están financiados. De estos 15, un total de 11 tienen restricciones de uso y solo seis tienen financiadas todas las indicaciones.
Reducir tiempo en MSE
Esta situación es otro elemento adicional por el que Pineros reclama una financiación acelerada de los medicamentos. El objetivo sería reducir al máximo el tiempo que un medicamento está sometido al procedimiento de situaciones especiales (MSE).
Además, hay que tener en cuenta que una de las medidas de control del gasto que más han crecido en los últimos tiempos es la regularización del precio desde el aplicado en MSE hasta el PVL autorizado. A este respecto, Pineros insiste en las dificultades que un largo periodo en MSE suponen para la gestión. “No es lo mismo regularizar tras 90 días de uso que hacerlo tras 700”, explica. Y esto afecta tanto a la economía de las compañías, como al número de pacientes que hay que modificar su tratamiento. Por ese motivo la directora del Departamento de Acceso de FI insiste en que “lo crítico aquí es tener una financiación acelerada, que no tengas necesidad de regularizar o que sea en un periodo corto”.
Por todo ello, Pineros aboga por la necesidad de un diálogo temprano donde se sepa qué ocurrirá en el momento de la autorización.
La elección de los medicamentos que deberían incluirse en el diálogo temprano y los procedimientos acelerados sería de la Administración. Ahí la industria quiere ser respetuosa con las prioridades que establezcan los gestores, explica Pineros quien, no obstante, señala a los medicamentos Prime como algunos ya preseleccionados por la propia EMA, si bien no son los únicos ya que “hay otros muchos medicamentos que no van por el esquema prime, que son fundamentales y también deberían tener una financiación acelerada”.
Hasta 1.280 días para ser financiados
Los medicamentos Prime que cuentan con resolución de financiación en España han tenido que esperar un total de 715 días para ser autorizados. Pese a este largo periodo, parece que pudiera estar acelerándose ya que tres de ellos (Hepcludex, Imcivree, Tecartus) recibieron sus decisiones de financiación ya en este 2024, al igual que Tecvayli y Xenpozyme que también recibieron resoluciones, en este caso de no financiación.
La espera máxima para la financiación alcanzó los 1.280 días, para el caso de Hepcludex, mientras que la mínima, 132 días, fue para Kymriah. Por su parte, las resoluciones de no financiación han llegado tras 557 días, siendo muy similar la espera en ambos casos.
En lo que se refiere a los medicamentos en estudio, la media de espera actual se sitúa en 457 días, con un máximo de 922 para Abecma y un mínimo de 81 días para Elrexfio.



















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 