La Asociación Española de Medicamentos Biosimilares, Biosim, celebra la publicación del borrador final de la Guía del Instituto Nacional para la Excelencia de la Salud y de la Asistencia (NICE) sobre el tratamiento de la artritis reumatoide, que amplía el acceso a varios tratamientos biológicos para pacientes con enfermedad moderada. La revisión permite, según Biosim, que 25.000 pacientes se beneficien de un acceso temprano a medicamentos biológicos.
Según explica esta entidad, la anterior versión de la Guía reservaba estos tratamientos tan sólo para pacientes con artritis grave. Así, medicamentos como adalimumab, etanercept e infliximab, antes indicados para artritis reumatoide grave, pasarán a pautarse a pacientes en estadios de enfermedad moderada.
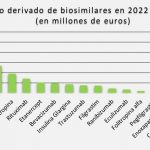
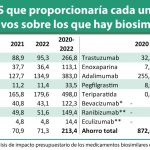
La nueva Guía constata que llegada de los medicamentos biosimilares ha reducido los costes del abordaje de esta patología, por lo que el comité ha revisado las recomendaciones del NICE sobre tratamientos biológicos. Meindert Boysen, director del Centro de Evaluación de Tecnología Sanitaria de NICE, asegura que “estas recomendaciones surgen después de una revisión realista de las Guías existentes en respuesta a la disponibilidad de biosimilares en el NHS”.
Según ha indicado Boysen, “nos complace comprobar que la introducción de biosimilares ha reducido los costes totales de los tratamientos, lo que permite a nuestro comité independiente recomendar tratamientos biológicos para más personas con artritis reumatoide, que podrán disfrutar de una mejor calidad de vida".
De esta forma, el propio NICE estima que unas 25.000 personas con artritis reumatoide moderada que no ha respondido a las terapias convencionales se beneficiarán de las recomendaciones anunciadas el pasado 10 de junio.
“Esta noticia constata una vez más la apuesta decidida del NICE por la eficiencia del gasto farmacéutico a través de acciones concretas”, según Encarnación Cruz, directora general de Biosim, “pero su relevancia va mucho más allá, pues por primera vez una entidad de tal reputación en la evaluación de medicamentos reconoce públicamente y de forma pragmática que la entrada de biosimilares y su reducción de costes obliga a una revisión de las guías de tratamiento existentes para adecuarlas a una nueva realidad, en la que la liberación de recursos se traduce en un acceso más temprano de los pacientes a terapias biológicas de alto impacto económico”.
“Reino Unido es un ejemplo de apuesta decidida e innovadora por los medicamentos biosimilares”, prosigue Cruz, “fueron pioneros en experimentar modelos de ganancias compartidas con biosimilares; tras su salida de la Unión Europa, su agencia reguladora de medicamentos acaba de publicar un documento de orientación para la autorización de productos biosimilares en línea con la recientes tendencia a reducir el desarrollo clínico; y ahora reposiciona los medicamentos biológicos cuyo ratio beneficio/coste ha mejorado gracias a la introducción de biosimilares”.
“Sería conveniente que este tipo de actuaciones se trasladaran también a nuestro país”, indica la directora de Biosim, “revisando aquellas guías de tratamiento en las que estén implicados medicamentos que cuentan con alternativa biosimilar. Una mayor eficiencia de estos últimos puede permitir que, como en el caso del NICE, se recomiende adelantar tratamientos con biológicos en aquellas situaciones en las que un tratamiento precoz mejore los resultados en salud de decenas de miles de pacientes”.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 