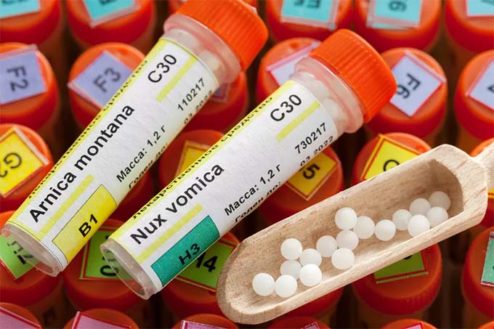
El Ministerio de Sanidad quiere trasladar al paciente la información necesaria acerca del procedimiento de registro simplificado especial para los medicamentos homeopáticos, “que no incluye la evaluación clínica del producto, no disponiéndose, por tanto, de evidencia científica que avale la eficacia del medicamento”.
Este es el principal objetivo de una nueva orden ministerial que el Ministerio de Sanidad ha iniciado a tramitar para regular determinados aspectos del etiquetado y prospecto de los medicamentos homeopáticos sin indicación terapéutica aprobada. Sanidad ha abierto un periodo de consulta pública previa, que finaliza el 15 de noviembre, para recibir aportaciones de la ciudadanía para empezar su tramitación.
El Ministerio de Sanidad quiere, por tanto, “incrementar el uso racional de los medicamentos homeopáticos sin indicación terapéutica aprobada”.
Sanidad explica en la justificación para el desarrollo de esta norma que las características particulares del procedimiento simplificado especial de los medicamentos homeopáticos, “deben ponerse de manifiesto al paciente, a fin de evitar errores de comprensión y/o expectativas infundadas del tipo de producto ante el que se encuentra.
Reacciones al registro
La tramitación de esta orden llega justo en el momento en que Sanidad ha dado el primer paso para la legalización de su registro de comercialización y, por tanto, podrán seguir siendo comercializados hasta su evaluación. A este respecto, la Federación de Asociaciones Científico Médicas Españolas (Facme) ha manifestado que “celebra y apoya” la posición de las autoridades sanitarias en relación a la homeopatía. Además, ha considerado que el registro de medicamentos homeopáticos “es clave para evitar una comercialización no controlada de dichos productos, además de ser la base para la inicial evaluación individualizada de sus características”.
Facme , también ha hecho hincapié en que cuando se trata de la investigación de un fármaco, “el proceso de desarrollo es largo y costoso ya que tiene que demostrar, a lo largo de sus distintas fases, que el medicamento reúne los requisitos de eficacia, seguridad y calidad exigidos para su comercialización y administración en personas”.
Por su parte, Boiron ha valorado como “muy positivo” que se avance en la normativa sobre autorización registro y dispensación de medicamentos homeopáticos. Boiron también ha indicado que los registros que ellos han presentado corresponden a cepas, y cada cepa “se traduce luego en distintas diluciones y presentaciones (gránulos o glóbulos)”, por lo que los 2.008 registros realizados se podrán convertir en varios miles de productos diferentes. Boiron procederá al registro de cada uno siguiendo los plazos establecidos, que acaban el 30 de abril de 2022.
La compañía ha aprovechado el comunicado para explicar que “siempre ha cumplido con los requisitos y la normativa establecida tanto por el Ministerio de Sanidad como por la Agencia del Medicamento, en su estricto cumplimiento de la legislación vigente, y así seguirá siendo”.

















 Lilisbeth Perestelo:
Lilisbeth Perestelo:  César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Un comentario
Me parece algo imprescindible
Es más, como las advertencias del tabaco, debería exigirse en envases y en el prospecto, el consejo de no evitar o abandonar las terapias racionales