El Consejo de Ministros de este 30 de noviembre ha aprobado la tramitación por el procedimiento de urgencia de un nuevo real decreto para regular la adecuación de la gestión de la prestación farmacéutica del Sistema Nacional de Salud al marco normativo de la verificación y autenticación de medicamentos.
El borrador de esta nueva norma, que ha sido compartido ya con los miembros del Sistema Español de Verificación de Medicamentos (Sevem) y que será discutido entre los representantes de este organismo y los del Ministerio de Sanidad el próximo martes, viene a regular dos aspectos principales: la creación del nodo SNSFarma y la actualización del cupón precinto.
Según este nuevo real decreto, al que ha tenido acceso Diariofarma, Nodo SNSFarma será de aplicación a todos los medicamentos sujetos a receta médica, si bien el título del real decreto restringiría al ámbito de la prestación farmacéutica del SNS la norma.
Supresión del cupón precinto
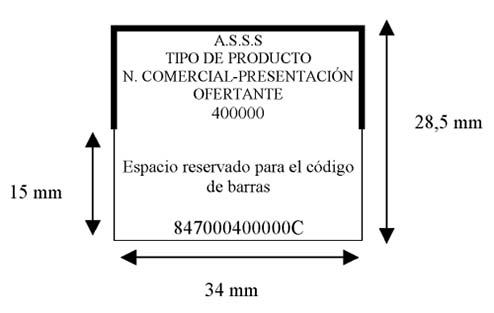
En cuanto a la actualización del cupón precinto, el borrador de real decreto establece que “una vez se encuentre totalmente implantado y en funcionamiento el Sistema Español de Verificación de Medicamentos, se podrá suprimir el cupón precinto de los medicamentos financiados por el SNS y dispensables en oficinas de farmacia” que lleven identificador único.
La información contenida en el cupón se deberá incorporar en el envase exterior del medicamento.
El cupón precinto “coexistirá con el identificador único” hasta la total implantación del Sevem y, “desde ese momento el identificador único se utilizará a efectos de reintegro de la prestación farmacéutica”.
Lo que no se determina en el borrador actual es qué sucederá en el momento en que coexistan, de forma plenamente activa para la facturación, ambos sistemas de prueba de dispensación. Es decir, mientras se va utilizando el identificador único para la facturación en envases que también presenten el cupón precinto.
Gestión de nodo SNSFarma
En cuanto al nodo SNSFarma, se establece que será gestionado por el Ministerio de Sanidad y que intercambiará información con el repositorio nacional de verificación de medicamentos (Sevem). Además, la Agencia Española de Medicamentos “supervisará el funcionamiento del repositorio que dé servicio a España, así como cualquier otro repositorio que se ubique en su territorio, verificando, en caso necesario mediante inspecciones o por otros medios, que el repositorio y la entidad jurídica responsable de su creación y gestión cumplen con lo establecido en el Reglamento Delegado”.
Además, se establece que la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia supervisará el “funcionamiento del nodo SNSFarma, así como la coordinación con las comunidades autónomas de las medidas y actuaciones relacionadas con la prestación farmacéutica que corresponda tomar”.
Nodo SNSFarma permitirá a las comunidades autónomas y otras entidades gestoras del SNS, “el envío de los datos de medicamentos a dispensar, con cargo a la mismas, por los servicios de farmacia hospitalaria y las oficinas de farmacia, su anonimización y verificación en el repositorio nacional, dando asimismo soporte a las tareas de supervisión y control por parte de las autoridades competentes”. Tras las validaciones internas y el proceso de anonimización, el nodo SNSFarma “enviará las correspondientes operaciones al repositorio nacional para la desactivación”.
Ampliación del ámbito de aplicación por gestión de la prestación
Del nuevo texto llama la atención que el Ministerio de Sanidad se reserva la potestad de ampliar la lista de medicamentos a los aplicar el identificador único con “fines de mayor control de la gestión y consumo de la Prestación Farmacéutica del Sistema Nacional de Salud”. De este modo, se amplían a causas de gestión y económicas la posible inclusión de nuevos medicamentos en la verificación unitaria.
Hasta ahora tal y como se recogía en la modificación del real decreto 1345/2007 se establecían solo razones sanitarias por las que, por resolución de la Agencia Española de Medicamentos, se podría incluir nuevos medicamentos en este sistema de seguridad.
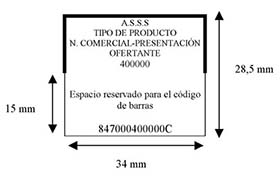 Una vez se encuentre totalmente implantado y en funcionamiento el Sistema Español de Verificación de Medicamentos, se podrá suprimir el cupón precinto de los medicamentos financiados por el SNS y dispensables en oficinas de farmacia.
Una vez se encuentre totalmente implantado y en funcionamiento el Sistema Español de Verificación de Medicamentos, se podrá suprimir el cupón precinto de los medicamentos financiados por el SNS y dispensables en oficinas de farmacia. 















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 