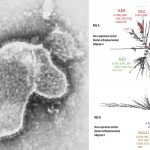
Laboratorios Moderna ha presentado este lunes ante la Agencia Europea de Medicamentos (EMA) la solicitud de aprobación de uso condicional para su vacuna frente al covid-19 en menores de 12 a 17 años.
La compañía basa su solicitud en los datos arrojados por el estudio en fase 2/3 (ARNM1273) para este grupo de edad, desarrollarlo en Estados Unidos sobre 2.500 adolescentes. Según la información facilitada a través de un comunicado, la eficacia de la vacuna fue del 100%, cuando se utilizó la misma definición de casos que en el ensayo COVE, en adultos.
Stéphane Bancel, director Ejecutivo de Moderna ha indicado que “nos alegra anunciar que hemos solicitado la aprobación condicional de la comercialización de nuestra vacuna ante la EMA, para su uso en adolescentes”.
En el estudio, según indica el laboratorio, se observó una eficacia de la vacuna de, 93% en los participantes seronegativos a partir de los 14 días después de la primera dosis.
La vacuna fue bien tolerada en general y la mayoría de los efectos adversos fueron de gravedad leve o moderada. Los efectos adversos más habituales fueron, dolor en el lugar de la inyección, después de la primera dosis y dolor de cabeza, fatiga, mialgia y escalofríos, tras la administración de la segunda.
El laboratorio presentará también una autorización para Canadá y la para FDA norteamericana, así como para otros reguladores.
“Nos alienta el hecho de que la vacuna de Moderna contra el covid-19 haya sido altamente eficaz Seguimos comprometidos en ayudar a acabar con la pandemia”, ha asegurado Bancel.

















 Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.: