Eli Lilly and Company ha anunciado hoy un acuerdo de adquisición con la Comisión Europea (CE) para suministrar hasta 220.000 dosis de la combinación de bamlanivimab y etesevimab (anticuerpos neutralizantes) para el tratamiento de la covid-19 en pacientes mayores de 12 años que no requieran oxigenoterapia y que tengan un alto riesgo de desarrollar enfermedad grave.
Este acuerdo, según explica la compañía, “ayuda a proporcionar un acceso rápido y equitativo a estos tratamientos al permitir que los países de la Unión Europea (UE) y del Espacio Económico Europeo (EEE) adquieran estos fármacos directamente de Lilly”, tras la aprobación nacional para uso de emergencia o la autorización de comercialización por parte de la UE. Las cantidades adquiridas pueden variar en función de las necesidades de cada país participante.
Este acuerdo de compra centralizada se toma tras la opinión científica positiva del Comité de Medicamentos de Uso Humano (CHMP) de la Agencia Europea de Medicamentos (EMA), que se hizo pública en marzo de este año y donde, en virtud del artículo 5(3) del Reglamento 726/2004, se apoyaba el uso de estos anticuerpos como tratamiento para la covid-19 en pacientes mayores de 12 años. Antes de que se otorgue una autorización de comercialización formal, esta opinión científica del CHMP respalda la toma de decisión a nivel nacional sobre el uso de tratamientos en los distintos Estados miembros de la UE, durante la emergencia de salud pública.
“Bamlanivimab y etesevimab están desempeñando un papel importante en la lucha contra la covid-19, ayudando a cientos de miles de pacientes en todo el mundo”, ha afirmado Alfonso Zulueta, vicepresidente sénior y presidente de Lilly International. “Lilly se complace de haber alcanzado este acuerdo con la Comisión Europea, un acuerdo que abre la puerta para que los países europeos accedan a estas opciones de tratamiento que salvan vidas para los pacientes con Covid-19 más vulnerables, especialmente a medida que las variantes como la Delta continúan aumentando su prevalencia”.
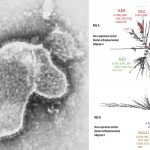
Los resultados de estudios preclínicos desarrollados por Lilly han demostrado que bamlanivimab y etesevimab administrados en combinación “mantienen la capacidad neutralizante frente distintas variantes que actualmente están circulando en muchos países, incluidas la Delta y la Alfa. Debido a la alta transmisibilidad de la variante delta, actualmente más del 90% de las nuevas infecciones por covid-19 en la UE/EEE se han identificado como causadas por dicha variante”. Según el Ministerio de Sanidad, 12 de 13 CCAA presentan una prevalencia de la variante superior al 90%.
La combinación de bamlanivimab y etesevimab está disponible como uso de emergencia para el tratamiento de la covid-19 en 15 países de todo el mundo.
En la primera mitad del año 2021, varios países europeos solicitaron bamlanivimab y etesevimab a Lilly pero aunque actualmente tengan stock disponible, este acuerdo permite que los países participantes puedan acceder a dosis adicionales en caso de que sean necesarias.
Aunque la combinación de bamlanivimab y etesevimab no ha recibido autorización definitiva de comercialización en la UE ni ha sido aprobada por la FDA, la utilización de bamlanivimab con etesivimab se encuentra aprobada por la FDA mediante una Autorización de Uso de Emergencia.
En marzo de 2021, el CHMP emitió una opinión científica positiva para bamlanivimab en monoterapia y bamlanivimab en combinación con etesevimab, recomendando su uso para el tratamiento de la covid-19 diagnosticado en pacientes a partir de 12 años que no requieran oxígeno suplementario y que tengan un alto riesgo de progresar a enfermedad grave.














 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 