Un ensayo en fase 3 recientemente publicado en Jama señala que el anticuerpo monoclonal de Lilly, donanemab de Lilly presenta una ralentización de la enfermedad de Alzheimer en un 35% en comparación al placebo en pacientes con niveles de tau en el cerebro de bajos a intermedios.
Estos datos han sido presentados también en la Conferencia Internacional de la Asociación de Alzheimer 2023 (AAIC) celebrada en Ámsterdam. Según explica Pablo Martínez-Lage, director científico de la Fundación Cita Alzheimer y neurólogo experto en Alzheimer, “estos resultados confirman la importancia que tiene el diagnóstico temprano y preciso de la enfermedad de Alzheimer”.
Según ha indicado, “el cambio significativo que donanemab produce sobre el devenir de la enfermedad será relevante para las personas que la sufren, especialmente en esas fases tempranas en las que podrán disfrutar más tiempo de una vida más autónoma, más satisfactoria y de mayor calidad.”
La solicitud de aprobación convencional de la Administración de Alimentos y Medicamentos (FDA) se completó el pasado trimestre de 2023 y se espera su resolución para finales de este año. A su vez, informa la compañía, se están tramitando las solicitudes con otros organismos reguladores sanitarios de todo el mundo.
Los resultados del ensayo Trailblazer-ALZ 2 incluyó a participantes con una gama más amplia de puntuaciones cognitivas y niveles de amiloide que otros ensayos recientes de terapias dirigidas contra la placa amiloide.
Los participantes en TRAILBLAZER-ALZ 2 fueron estratificados-ALZ según su nivel de tau, un biomarcador predictivo de la progresión de la enfermedad, en un grupo de ‘tau bajo-medio’ (a veces denominado como tau intermedio) y en un grupo de ‘tau alto’, que representa una fase patológica más avanzada de la enfermedad. Después, se evaluó a todos los participantes durante 18 meses utilizando escalas que miden el deterioro cognitivo y funcional, incluida la Escala Integrada de Evaluación de la enfermedad de Alzheimer y la tabla de Valoración Clínica de Demencia (CDR-SB).
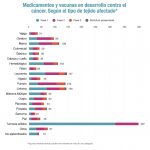
Entre los pacientes con niveles bajos-medios de tau (n=1.182), el tratamiento con donanemab ralentizó significativamente el deterioro en un 35% según la Escala y en un 36% en base a la CDR-SB-. Entre todos los participantes en el estudio con síntomas tempranos de alzhéimer y presencia de placa amiloide (n=1.736), el tratamiento con donanemab ralentizó significativamente el deterioro en un 22% en la iADRS y en un 29% en la CDR-SB.
A su vez, los datos adicionales presentados en AAIC refuerzan el hecho de que, independientemente del estadio clínico o patológico basal de la enfermedad, el tratamiento con donanemab “genera beneficios a nivel cognitivo y funcional en comparación con placebo”, informa la compañía.
En participantes con deterioro cognitivo leve, donanemab ralentizó el deterioro en un 60% en la escala iADRS y en un 46% en la escala CDR-SB. Para aquellos con demencia leve debido a la enfermedad de Alzheimer el fármaco ralentizó el deterioro en un 30% en la iADRS y en un 38% en la CDR-SB, respectivamente.
En los participantes menores de 75 años donanemab ralentizó el deterioro en un 48% en la iADRS y en un 45% en la CDR-SB y en participantes de 75 años o más (n=266), donanemab ralentizó el deterioro en un 25% en la iADRS y en un 29% en la CDR-SB.
“Los datos positivos de Trailblazer-ALZ 2 aportan esperanza a las personas con enfermedad de Alzheimer que necesitan urgentemente nuevas opciones de tratamiento. Se trata del primer ensayo de fase 3 de una terapia que modifica la evolución de la enfermedad que reproduce los resultados clínicos positivos obtenidos en un estudio anterior”, ha declarado Anne White, vicepresidenta ejecutiva de Eli Lilly and Company y presidenta de Lilly Neuroscience.
“Si se aprueba, creemos que donanemab puede proporcionar beneficios clínicamente significativos a las personas con esta enfermedad. Además de la posibilidad de completar su tratamiento en tan solo 6 meses una vez eliminada la placa amiloide. Por ello, debemos seguir superando cualquier barrera en el acceso a las terapias amiloides y las pruebas de diagnóstico en un ecosistema sanitario ya de por sí complejo para la enfermedad de Alzheimer”.
Donanemab se dirige específicamente a la placa amiloide depositada en el cerebro y se ha demostrado que ha conseguido su eliminación en los pacientes tratados en los ensayos clínicos. Así, el tratamiento con donanemab redujo significativamente los niveles de placa amiloide independientemente del estadío patológico basal de la enfermedad. En el conjunto de pacientes incluidos en el estudio, donanemab redujo la placa amiloide en una media del 84% a los 18 meses de tratamiento, frente a una disminución del 1% en los pacientes que recibieron placebo. Los pacientes cesaron el tratamiento una vez habían alcanzado los criterios previamente definidos de eliminación de placa amiloide.
“Las personas con enfermedad de Alzheimer sintomática en una fase temprana siguen trabajando, disfrutando de viajes, compartiendo tiempo de calidad con la familia... quieren sentirse como ellos mismos durante más tiempo”, afirmó el Dr. Mark Mintun, vicepresidente del grupo de Investigación y Desarrollo en Neurociencia de Lilly y presidente de Avid Radiopharmaceuticals. “Los resultados de este estudio refuerzan la importancia de diagnosticar y tratar la enfermedad antes de lo que lo hacemos hoy”.
Con respecto a efectos adversos, la incidencia de alteraciones de neuroimagen relacionadas con el amiloide (ARIA) y de reacciones adversas vinculadas con la infusión de donanemab fue coherente con el estudio anterior. Las ARIA son comunes con todas las terapias con anticuerpos dirigidos a la eliminación de la placa amiloide. Las que se han observado más comúnmente son inflamación transitoria en un área o áreas del cerebro (ARIA-E) o microhemorragias o siderosis superficial (ARIA-H), ambas detectadas por resonancia magnética, pudiendo ser graves e incluso mortales en algunos casos. Este riesgo debe gestionarse con seguimiento cuidadoso y monitorización con resonancia magnética para poder tomar las acciones apropiadas si se detectan. También se observaron reacciones adversas graves relacionadas con la infusión y anafilaxia.
















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 