La Administración de Alimentos y Medicamentos de los Estados Unidos aprobó Merilog (insulina-aspart-szjj) como biosimilar de Novolog (insulina aspart) para mejorar el control de la glucemia en pacientes adultos y pediátricos con diabetes mellitus.
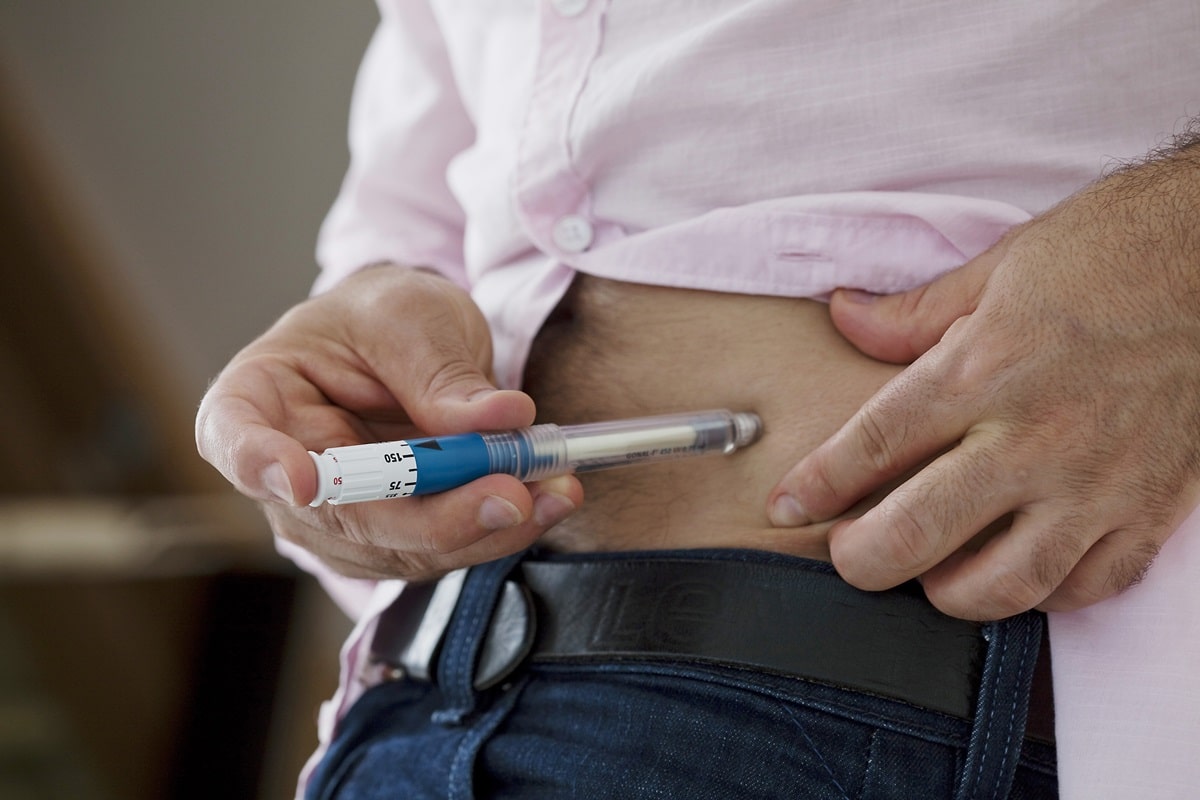
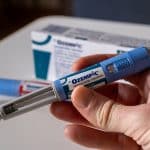
Merilog, un análogo de insulina humana de acción rápida, es el primer biosimilar de insulina de acción rápida aprobado por la FDA. Como insulina de acción rápida, Merilog ayuda a reducir los picos de azúcar en sangre a la hora de comer para mejorar el control del azúcar en sangre en personas con diabetes. La aprobación es tanto para una pluma precargada de uso único de 3 mililitros (ml) como para un vial de dosis múltiples de 10 mililitros (ml).
Merilog es el tercer producto biosimilar de insulina aprobado por la FDA y se suma a los dos productos biosimilares de insulina de acción prolongada aprobados en 2021 por la FDA. La aprobación de productos biosimilares puede aumentar el acceso de los pacientes a opciones de tratamiento seguras y efectivas.
“La FDA ha aprobado ahora tres productos biosimilares de insulina para tratar la diabetes”, dijo Peter Stein, director de la Oficina de Nuevos Medicamentos en el Centro de Evaluación e Investigación de Medicamentos de la FDA. “Esta aprobación destaca nuestros esfuerzos continuos para mejorar la eficiencia del proceso de aprobación de biosimilares para ayudar a respaldar un mercado competitivo y aumentar las opciones para tratamientos costosos, como la insulina. Aumentar el acceso a medicamentos seguros, efectivos y de alta calidad a un costo potencialmente menor sigue siendo una prioridad continua para la FDA”.
Más de 38 millones de personas en los EE. UU. han sido diagnosticadas con diabetes. Aproximadamente 8,4 millones de estadounidenses dependen de la terapia con insulina, ya sea de acción rápida o de acción prolongada, para controlar la diabetes.
“Para los millones de personas que dependen de inyecciones diarias de insulina para el tratamiento de la diabetes, tener una opción biosimilar para su inyección de insulina de acción rápida puede realmente marcar la diferencia, ya que los productos biosimilares tienen el potencial de aumentar el acceso a estos medicamentos que salvan vidas”, dijo Sarah Yim, directora de la Oficina de Productos Biológicos Terapéuticos y Biosimilares en el Centro de Evaluación e Investigación de Medicamentos de la FDA.
Al igual que Novolog, Merilog debe administrarse entre cinco y diez minutos antes del inicio de una comida. Merilog se administra por vía subcutánea (debajo de la piel) mediante una inyección en el estómago, las nalgas, los muslos o la parte superior de los brazos. La dosis de Merilog debe individualizarse y ajustarse según las necesidades del paciente.
Merilog puede causar efectos secundarios graves, incluida la hipoglucemia (nivel bajo de azúcar en sangre), reacciones alérgicas graves e hipocalemia (nivel bajo de potasio en sangre). Otros efectos secundarios comunes pueden incluir reacciones en el lugar de la inyección, picazón, sarpullido, lipodistrofia (engrosamiento o formación de hoyuelos en la piel en el lugar de la inyección), aumento de peso e hinchazón de manos y pies.















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: