Hasta el 69% de los retrasos se producen después de que las empresas hayan presentado sus solicitudes y estén a la espera de la decisión de un Estado miembro. Así lo asegura el último informe presentado por la Federación Europea de la Industria Farmacétuica (Efpia) sobre obstáculos de acceso en el que se detallan las causas fundamentales de la falta de disponibilidad de medicamentos innovadores en Europa.
Este informe se presenta acompañando a los datos dados a conocer por el Informe WAIT la pasada semana en el que se ponía de relieve el “estancamiento” europeo en los tiempos de acceso a las innovaciones farmacéuticas.
Nathalie Moll, directora general de la Efpia ha señalado que los datos de este estudio “demuestran claramente los obstáculos sistemáticos que impiden que los nuevos medicamentos lleguen a los pacientes”. En ese sentido reclama que “las soluciones pasan por la colaboración entre los sistemas sanitarios, los gobiernos y la industria”. “Hacen “hacen falta dos para lanzarse, no podemos resolver una cuestión tan compleja con un planteamiento único en la legislación”, asevera Moll.
Igualmente, la directora general asegura que “las propuestas legislativas de miras estrechas como obligar a las compañías a lanzar y suministrar continuamente productos en todos los Estados miembro fracasarían por completo a la hora de abordar las causas reales y basadas en pruebas de los retrasos”.

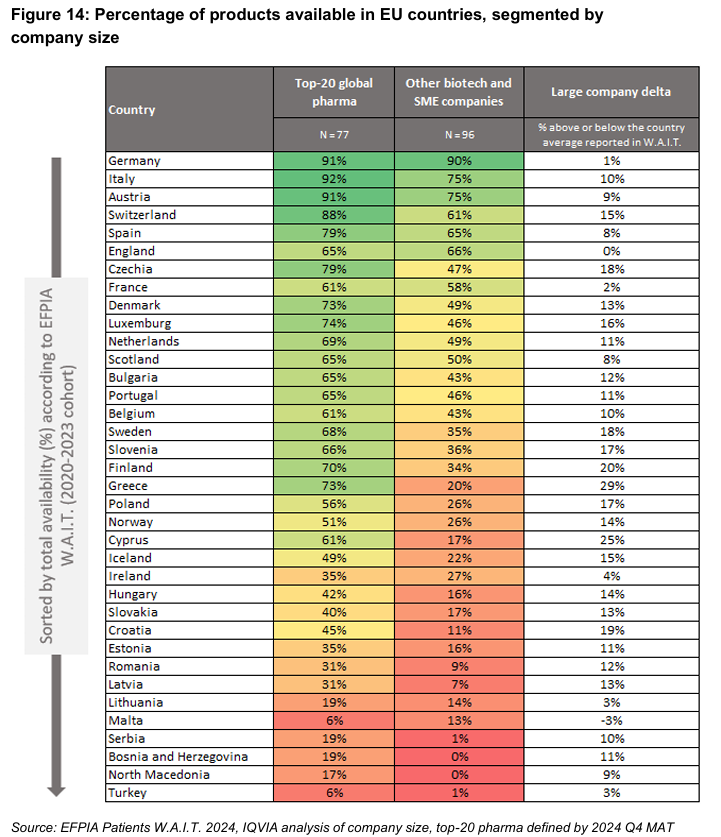
Basándose en datos extraídos del informe WAIT, el trabajo de la Efpia sobre las causas profundas de la diferencia en el acceso asegura que “la evidencia demuestra sistemáticamente que la EMA es más lenta que la FDA” y ello lo ejemplifica con los medicamentos oncológicos: "Un estudio de 2025 revisó 152 nuevas terapias oncológicas aprobadas tanto por la FDA como por la EMA entre enero de 2003 y diciembre de 2024 y descubrió que el 94 % fueron aprobadas por la FDA antes que por la EMA”.
Igualmente, el trabajo apunta hacia “una relativa infrautilización de las vías de revisión acelerada en la UE en comparación con otros organismos reguladores”. En el plano nacional, la Efpia llama la atención sobre “el largo proceso” de pago y reembolso (P&R) una vez que el producto recibe autorización de la EMA, debido a la elaboración de “expedientes personalizados para cada país”, además de las “normas sobre los plazos para la toma de decisiones, incluida la dependencia de las decisiones de otros países”. A todo ello sigue “el retraso inevitable durante la negociación del precio”, que es desigual en cada país en función del precio.
Desde la Efpia se plantean cinco propuestas que permitirían mejorar la disponibilidad de medicamentos innovadores. En relación a agilizar el proceso regulatorio, la Efpia plantea alinear los plazos de aprobación con las mejores prácticas internacionales; en relación, por ejemplo, a los planteamientos de la FDA. Igualmente aboga por aportar eficiencia a las agencias evaluadoras y diseñar un proceso que permita que los precios se alineen con el valor y la capacidad de pago.



















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: