Profesionales y pacientes "no tienen una buena comprensión” del concepto de aprobación condicional, o acelerada, en la atención a los procesos oncológicos. Así lo señala un reciente trabajo publicado por la Sociedad Americana de Farmacología Clínica (ASCPT) sobre este procedimiento dentro del escenario regulador de la Unión Europea.
El objetivo de este estudio, es describir las perspectivas y las compensaciones de los reguladores de la UE sobre las aprobaciones aceleradas para tratamientos de pacientes con cáncer avanzado y se realizó en base a una encuesta transversal con evaluadores y expertos de la red de la Agencia Europea de Medicamentos (EMA).
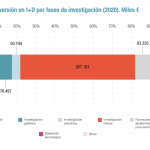
El trabajo recoge en primer lugar las actitudes generales ante la situación, a partir de la cual se realizó un análisis conjunto para evaluar la compatibilidad de la ‘aprobación condicional’ para diferentes escenarios de tasa de respuesta, duración de la respuesta y toxicidad de un ensayo de un solo brazo, así como la puntualidad de los datos confirmatorios. La encuesta fue completada por 60 participantes de los 351 invitados.
La mayoría coincidió en que la aprobación condicional “no es bien comprendida por pacientes y médicos” y la confianza en las vías aceleradas y la evidencia temprana varía de forma importante entre los encuestados.
Situaciones de necesidad
La cuestión no es nueva. Las aprobaciones aceleradas, como la ‘aprobación condicional’ en la UE o la ‘aprobación acelerada’ en EE. UU., permiten la autorización de nuevos fármacos o indicaciones farmacológicas prometedoras antes de que se disponga de datos exhaustivos. Estas autorizaciones de comercialización pueden utilizarse en situaciones de gran necesidad médica insatisfecha, cuando los beneficios potenciales del acceso temprano superan los riesgos asociados a la evidencia incompleta.
En la UE, donde esta disposición se aplica a nuevos fármacos y no a indicaciones complementarias, aproximadamente la mitad de las aprobaciones condicionales se han referido a solicitudes de nuevos fármacos para indicaciones oncológicas, y alrededor del 5% de las aprobaciones de nuevos fármacos contra el cáncer se han otorgado de forma condicional.
En EE. UU., donde la disposición se aplica tanto a indicaciones iniciales como complementarias, alrededor del 85 % de las aprobaciones aceleradas de la última década se destinaron a indicaciones de productos oncológicos. Entre 1992 y 2017, el 35 % de las indicaciones de productos oncológicos recibieron aprobación acelerada.
Si bien las aprobaciones aceleradas de medicamentos oncológicos ofrecen un acceso rápido a pacientes con necesidades no cubiertas, la evidencia directa para cuantificar los efectos del tratamiento suele ser insuficiente. Además, a pesar del limitado beneficio adicional demostrado, muchos de estos medicamentos recuperan rápidamente los costos de I+D, lo que plantea interrogantes sobre las prácticas de reembolso que no se ajustan a las incertidumbres sobre las estimaciones de beneficios.
En la UE, se puede otorgar una aprobación condicional cuando un medicamento cumple criterios específicos, como una relación beneficio-riesgo positiva, la probabilidad de obtener datos posautorización completos, la satisfacción de una necesidad médica no cubierta y que el beneficio inmediato para los pacientes supere los riesgos de datos incompletos. Estas autorizaciones tienen una validez de un año y pueden renovarse anualmente. El titular debe cumplir obligaciones específicas dentro de plazos definidos, como completar estudios o recopilar datos adicionales para confirmar que el balance beneficio-riesgo del medicamento se mantiene positivo.
El estudio quiere describir las actitudes y los atributos que pueden influir en las decisiones regulatorias para la aprobación acelerada. Preguntamos a los evaluadores clínicos de la red de evaluadores de la EMA sobre sus actitudes generales respecto a las aprobaciones aceleradas y sobre el grado de convicción de escenarios hipotéticos de solicitud de medicamentos que consisten en diferentes combinaciones de tasa de respuesta objetiva, toxicidad y plazo previsto de ensayos confirmatorios.
Esta encuesta transversal se realizó para recopilar la opinión general de los reguladores oncológicos de la UE respecto a las aprobaciones aceleradas y evaluar la importancia relativa de factores como la actividad antitumoral, la toxicidad y el momento oportuno para los estudios confirmatorios a la hora de determinar la idoneidad de una aprobación acelerada. El estudio proporciona información sobre cómo estos elementos clave influyen en las decisiones regulatorias en el contexto de las vías aceleradas y sobre la opinión de los reguladores acerca de cómo equilibrar el acceso rápido de los pacientes y la necesidad de evidencia sólida.
Los encuestados eran profesionales con experiencia que participaban activamente en el sistema regulatorio como evaluadores o expertos de diversos países, lo que otorga credibilidad a los resultados, que pueden aportar información valiosa, especialmente en lo que respecta a la diversidad de opiniones.
En cuanto a las actitudes generales, la gran mayoría de los participantes coincidió en interpretar la actividad destacada (“p. ej., TRO > 70 %, mediana de DRO > 24 meses”) como un indicador de eficacia y de la mayor probabilidad de éxito de las solicitudes en el caso de cánceres raros. Sin embargo, la mayoría también coincidió en la necesidad de RCTs bien avanzados en el momento de la aprobación y en la preocupación por la posible toxicidad. Estas opiniones ponen de relieve los dilemas asociados a la agilización de la aprobación cuando se carece de evidencia exhaustiva.
Uso de controles externos
Las opiniones variaron en cuanto a muchos otros aspectos, como la utilidad de los controles externos para complementar los ensayos de un solo brazo, si los CMA están bien planificados para entregar estudios confirmatorios oportunos, si la aprobación acelerada en última instancia retrasa el acceso y si existe mayor preocupación por retrasar el acceso que por la toxicidad innecesaria. El análisis factorial exploratorio identificó tres subgrupos distintos de actitudes en términos de confianza en las vías aceleradas y los estándares de evidencia (“de apoyo”, “pragmático” y “cauteloso”).
En cuanto a las compensaciones, el análisis conjunto confirmó que una mayor actividad antitumoral podría compensar una mayor toxicidad o un mayor tiempo de confirmación. Los rangos de atributos estudiados parecieron ponderarse de manera similar, excepto por el menor impacto de un aumento en la tasa de respuesta para los grupos "pragmático" y "cauteloso". Existe la oportunidad de estudiar más a fondo la utilidad percibida de la respuesta objetiva en diferentes contextos clínicos.
Este análisis también destacó el interés en los estudios comparativos externos para describir los criterios de valoración relacionados con el tiempo en el contexto de ensayos clínicos de un solo brazo. Se está llevando a cabo un estudio adicional con organismos reguladores y médicos para describir mejor el posible papel de los estudios comparativos externos en la interpretación de los resultados de los ensayos de un solo brazo.
Las opiniones sobre el riesgo de que la aprobación acelerada retrase el acceso, dado que la aprobación "puede retrasar la finalización de los ensayos confirmatorios y, en última instancia, el acceso a los pacientes", fueron diversas. De hecho, los organismos de reembolso podrían dudar en apoyar la financiación ha sta que se disponga de evidencia más sólida.
La aprobación acelerada suele justificarse por resultados prometedores derivados de evidencia limitada, junto con la expectativa de que los beneficios del tratamiento en la población objetivo superen cualquier riesgo, a pesar de la incompleción de los datos. Sin embargo, las suposiciones básicas que subyacen a este razonamiento —como las presuntas relaciones entre los marcadores clínicos tempranos y los beneficios clínicos reales, así como la relevancia de los hallazgos de ensayos pequeños para la población objetivo más amplia— suelen ser implícitas. Esta falta de transparencia puede obstaculizar los debates efectivos entre los revisores y complicar la comunicación con los profesionales de la salud, los pacientes y otras partes interesadas del sistema sanitario.
Marcos beneficio-riesgo
Los marcos actuales de beneficio-riesgo para las decisiones de aprobación ofrecen una estructura para articular estos aspectos críticos al mencionar las “incertidumbres” y las “actitudes ante el riesgo”; sin embargo, aún existe la oportunidad de mejorar su detalle, especialmente en el contexto de las aprobaciones aceleradas.
Esto podría lograrse, en primer lugar, explican los autores, describiendo las incertidumbres de la forma más completa y explícita posible. Esto incluye aclarar a qué se refiere la incertidumbre (p. ej., efectos sobre la supervivencia o reacciones adversas raras), su naturaleza (p. ej., falta de claridad sobre la relevancia clínica de los datos observados o datos faltantes), sus causas principales (p. ej., relaciones desconocidas entre los indicadores tempranos y los resultados en diversos tratamientos, tamaños de muestra pequeños o duración insuficiente del seguimiento) y las estrategias para abordar estas incertidumbres (p. ej., suposiciones sobre los efectos del tratamiento y solicitudes de datos adicionales).
En segundo lugar, indican, sería esencial transmitir con precisión las consecuencias previstas del tratamiento en términos de beneficios y riesgos esperados, yendo más allá de las meras observaciones de ensayos que suelen presentarse en las tablas de efectos.
Por ejemplo, señalan, afirmar que la respuesta observada fue alta y que la relación beneficio-riesgo es positiva proporciona una visión limitada de los resultados esperados. Una declaración más informativa sería: "Se proyecta que la respuesta observada del 45 % se corresponda con un aumento de la mediana de supervivencia de 1 a 6 meses, aunque esto se basa en la opinión de expertos médicos y no en evidencia empírica".
Los enfoques cuantitativos que delinean claramente los juicios de valor podrían resultar particularmente beneficiosos en estos escenarios. Al separar y articular claramente las relaciones asumidas entre los criterios de valoración, junto con los juicios de valor mediante un marco estandarizado, las partes interesadas pueden obtener una comprensión más clara y facilitar diferentes interpretaciones y decisiones a medida que evolucionan los datos. Si bien la implementación de estas estrategias puede requerir un esfuerzo adicional, esta inversión parece justificada, ya que promueve la toma de decisiones informada y autónoma en condiciones de incertidumbre —donde las actitudes de riesgo de los pacientes son fundamentales— y permite a otras partes interesadas dentro del sistema de salud tomar sus decisiones con mayor eficacia.
Los autores del trabajo reconocen que “las limitaciones de este estudio incluyeron el pequeño tamaño de la muestra y la elección simplificada de atributos y rangos”. De hecho, la incertidumbre sobre los atributos no se consideró explícitamente. Por ejemplo, los resultados de los estudios confirmatorios debían presentarse después de 6 o 60 meses, sin considerar la probabilidad de que los estudios confirmatorios se presentaran a tiempo.
Actitud diversa
En general, las actitudes de los evaluadores y expertos hacia la aprobación acelerada fueron diversas. Esto refleja los debates más amplios entre los reguladores y otras partes interesadas en los sistemas de salud. Por un lado, las aprobaciones aceleradas en oncología han permitido que terapias innovadoras estén disponibles para los pacientes años antes de lo que sería posible de otro modo.
Por otro lado, existe la preocupación de que los beneficios de estas terapias puedan tardar demasiado en confirmarse o, en última instancia, no confirmarse en absoluto. Si bien la planificación óptima de la generación de evidencia es clave, existe la oportunidad de fomentar la convergencia entre los reguladores de medicamentos sobre la evidencia requerida para la aprobación, incluyendo el papel de los estudios comparativos externos para complementar los ensayos de un solo brazo, y mejorar la comunicación sobre las aprobaciones aceleradas a pacientes, médicos y otros actores de los sistemas de salud para que sus decisiones estén mejor fundamentadas.

















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: