Farmaindustria, a través de la Plataforma de Medicamentos Innovadores y en colaboración con la Asociación de Medicina de la Industria Farmacéutica (AMIFE), ha elaborado la 'Guía de Unidades de Investigación Clínica en Pediatría'Farmaindustria, a través de la Plataforma de Medicamentos Innovadores y en colaboración con la Asociación de Medicina de la Industria Farmacéutica (AMIFE), ha elaborado la 'Guía de Unidades de Investigación Clínica en Pediatría'. El objetivo de esta iniciativas es ayudar a promover el trabajo en red y la puesta en marcha de unidades específicas en los hospitales para desarrollar ensayos clínicos y también consolidar a España como referencia en investigación pediátrica y atraer inversión en este ámbito.
La Guía constituye, según la patronal, un completo mapa de los equipos de investigación pediátrica en España y ofrece una completa información de la situación actual de este tipo de investigación a partir de los datos suministrados por los responsables de estas unidades, actualizados a julio de 2017. Así, según el documento, España contaría a día de hoy con 30 unidades de investigación clínica pediátrica, que a su vez disponen de 1.730 camas, lo que supone un promedio de 62 camas por centro implicado, y están ubicadas, en su inmensa mayoría, en hospitales públicos (21). Además hay siete en hospitales privados y dos en centros público-privados. Aunque la actividad de todas las unidades está orientada a estudios con pacientes, en 20 de ellas existe la posibilidad de realizar estos estudios con voluntarios sanos.
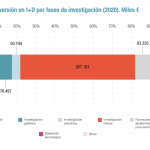
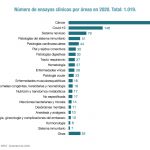
Hasta el momento, se habrían llevado a cabo un total de 2.123 participaciones en estudios de investigación en los últimos cinco años (de las que 1.271 corresponden a participaciones en ensayos clínicos en los últimos cinco años, 682 estudios observacionales y 170 estudios de investigación propia). El 51% de los ensayos clínicos realizados de forma conjunta con un laboratorio farmacéutico corresponde a la fase III (en la que los fármacos se prueban ya con un número importante de pacientes y se comparan con el tratamiento estándar), mientras que el 33% se ubica en las fases tempranas, donde se prueba la seguridad y eficacia de un nuevo fármaco en un número limitado de pacientes. En el caso de los ensayos realizados por grupos independientes estos porcentajes son del 47% (fase III) y 33% (fases I y II).
Se ha presentado en la Jornada sobre Investigación Clínica en Pediatría, celebrada hoy en el Hospital Infantil Universitario Niño Jesús, en la que, además de profesionales del centro, han participado representantes de la Red Española de Ensayos Clínicos Pediátricos (Reclip), Amife, la Agencia Española de Medicamentos y Productos Sanitarios (Aemps), la Plataforma Española de Medicamentos Innovadores y Farmaindustria.

















 :
:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:  Margarita de la Pisa, eurodiputada de Vox.:
Margarita de la Pisa, eurodiputada de Vox.:  Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):
Ion Arocena, director general de la Asociación Española de Bioempresas (Asebio):  Javier Padilla, secretario de Estado de Sanidad:
Javier Padilla, secretario de Estado de Sanidad: