El coste de adaptar las líneas de producción para facilitar la verificación unitaria de medicamentos alcanzará los 200 millones de euros para las empresas que producen medicamentos en nuestro país. Esta cifra obedece a una estimación realizada por Farmaindustria tras haber elaborado una encuesta con el objetivo de conocer el número de líneas que habría que adaptar, teniendo en cuenta que el coste unitario sería de entre 200.000 y 400.000 euros. Así lo explicó el director técnico de Farmaindustria, Emili Esteve, durante su intervención en la mesa ‘La trazabilidad total a debate’ que tuvo lugar en el 61 Congreso de la Sociedad Española de Farmacia Hospitalaria (SEFH) en Gijón.
“No es una cuestión barata. Hay que poner los precintos y dispositivos de seguridad y luego hay que serializar cada envase”, explicó Esteve y, además, hay que tener en cuenta que esa cifra de 200 millones es solo para adaptar la maquinaria y empezar a funcionar. Posteriormente habrá unos gastos de funcionamiento, que serán de carácter permanente, entre otras cuestiones, por ejemplo, los sellos de seguridad que tendrá que llevar cada envase.
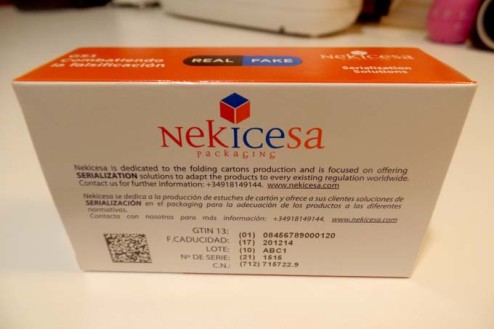
Con él coincidió la directora técnica de Aeseg, Amalia Avilés, que explicó que, según sus datos el coste de cada línea que deba imprimir el datamatrix y serializar asciende a 300.000 euros. A ello hay que sumarle 150.000 euros por la tecnología para insertar en cada envase el sello antifalsificación.
Cinco millones para el Sevem
Aparte de estos costes que tendrá que asumir cada compañía en sus propias plantas de producción, hay unos costes que serán soportados por todas ellas en función de un cálculo de cuota que le corresponda para sostener el Sistema Español de Verificación de Medicamentos (Sevem) y que, según las estimaciones realizadas ascenderá a 5 millones de euros al año. Cifra que se suma a los costes del nodo europeo, que Farmaindustria estima en un coste de entre 10 y 13 millones de euros para su lanzamiento, entre 2016 y 2018, y entre 5,5 y 8 millones de euros a partir de 2019.
Aunque los representantes de la industria manejan cifras de magnitud similar, la representante de la Agencia Española de Medicamentos presente en el debate, su subdirectora de Control Farmacéutico, Belén Escribano indicó, sin dar valor alguno que “las cifras de la Comisión Europea sobre impacto son inferiores a las que habla la industria”.
Otro coste, aunque aún no hay cifras, es el que tendrán que asumir las oficinas de farmacia, los hospitales y la distribución para poder leer los códigos datamatrix que aparecerán en los envases. Una inversión que, como se recordará, tendrá que estar realizada antes del 9 de febrero de 2019, fecha en la que solo se podrá dispensar un medicamento en la Unión Europea si se ha verificado su autenticidad. Eso sí, para las farmacias tendrá la contrapartida de poder terminar con el papel al poder prescindir del cupón precinto para la facturación al Sistema Nacional de Salud.


















 César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:
César Hernández, director general de Cartera y Farmacia del Ministerio de Sanidad:  Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia: 