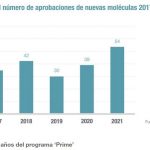
Farmaindustria ha emitido un comunicado, con motivo del Día Mundial de las Enfermedades Raras, que se celebra este miércoles 28 de febrero, en el que subraya el compromiso de sus laboratorios asociados "con la investigación y el desarrollo de tratamientos para aquellas enfermedades poco frecuentes cuyos pacientes aún no disponen de alternativas terapéuticas adecuadas". Consideran que la industria ha hecho de éste "un objetivo primordial" y citan, para argumentar su afirmación, el dato que indica que el 40% de todos los medicamentos que incluyen un nuevo principio activo y que han sido aprobados en Europa y Estados Unidos en 2017 están indicados para el abordaje de patologías poco frecuentes.
En el caso de la Agencia Europea de Medicamentos (EMA), la patronal recuerda que el 40% de los 35 medicamentos con un nuevo principio activo que recibieron opinión positiva de la EMA, es decir 14, son para tratar enfermedades poco frecuentes, y recuerdan que la propia EMA señala que el actual marco vigente sobre enfermedades raras favorece la I+D en estas dolencias por parte de la industria, destacando además las aportaciones terapéuticas de los nuevos fármacos huérfanosen patologías como la queratitis neurotrófica, el neuroblastoma o el síndrome carcinoide, entre otras.
En lo que se refiere a la agencia americana (FDA), un total de 18 medicamentos, que representan el 39% de las nuevas moléculas aprobadas por la FDA durante el año pasado, son terapias dirigidas a enfermedades poco frecuentes. Entre estos nuevos medicamentos, la FDA destaca habría destacado un nuevo fármaco para tratar una forma específica de la enfermedad de Batten y otro dirigido a prevenir o reducir los episodios hemorrágicos en pacientes con un tipo concreto de hemofilia A.
Buenos augurios para el futuro
Emili Esteve, director del Departamento Técnico de Farmaindustria, asocia estos buenos resultados en medicamentos huérfanos con "las políticas de protección de la propiedad industrial aplicadas a estos fármacos, puesto que han favorecido notablemente su investigación y desarrollo en beneficio de todos". A su juicio, no obstante, "queda mucho camino por recorrer", aunque reconoce que los datos sobre los nuevos tratamientos disponibles para combatir las enfermedades poco frecuentes "son esperanzadores y demuestran que si todos los agentes implicados (industria, administraciones, profesionales sanitarios, centros de investigación, hospitales, etc.) continuamos trabajando juntos dentro de un marco legal favorecedor de la I+D seguiremos logrando buenos resultados para los pacientes en los próximos años".


















 Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:
Kilian Sánchez, secretario de Sanidad del PSOE y portavoz de la Comisión de Sanidad del Senado.:  Rocío Hernández, consejera de Salud de Andalucía:
Rocío Hernández, consejera de Salud de Andalucía:  Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):
Nicolás González Casares, eurodiputado de Socialistas & Demócratas (S&D - PSOE):  Juan José Pedreño, consejero de Salud de Murcia:
Juan José Pedreño, consejero de Salud de Murcia:  Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados:
Carmen Martínez, portavoz del Grupo Socialista en la Comisión de Sanidad del Congreso de los Diputados: